







| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质质量/g | 8 | 2 | 8 | 12 |
| 反应后物质质量/g | 4 | 16 | X | 2 |
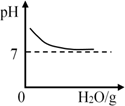 常温下向装有澄清石灰水的烧杯中逐渐加水
常温下向装有澄清石灰水的烧杯中逐渐加水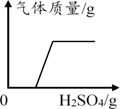 向装有氢氧化钠和碳酸钠混合溶液的烧杯中滴加稀硫酸
向装有氢氧化钠和碳酸钠混合溶液的烧杯中滴加稀硫酸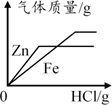 向装有等质量锌、铁的两只烧杯中分别加足量等浓度的稀盐酸
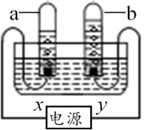
向装有等质量锌、铁的两只烧杯中分别加足量等浓度的稀盐酸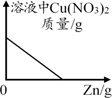 向装有硝酸铜和硝酸银混合溶液的烧杯中逐渐加入金属锌
向装有硝酸铜和硝酸银混合溶液的烧杯中逐渐加入金属锌

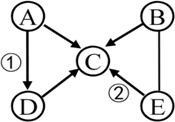
| 实验步骤 | 实验现象 | 实验结论 |
| 取一定量滤液于试管中,加入足量CaCl2 溶液,充分振荡后,再滴加酚酞溶液. | 溶液呈红色 | 由此确定原粉末 中含有 |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取一定量过滤所得固体于试管 中,加入足量稀HCl,充分振荡. | 有气泡产生, 沉淀完全溶解 | 上述猜想 可能成立 |
| (2)向(1)试管中,继续滴加足量的 NaOH溶液 | 有白色沉淀产生 | 上述猜想 一定成立 |
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 加入氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 |
| 共生成沉淀的质量/g | 5.35 | 10.7 | m | 21.4 | 21.4 |