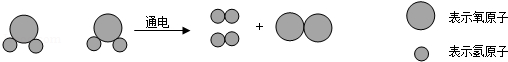
16.实验室常用的干燥剂有浓硫酸、碱石灰(CaO和NaOH的固体混合物)等,后者在潮湿的空气中易变质。某化学兴趣小组对实验室中一瓶久置的碱石灰展开探究。
【查阅资料】①碱石灰易吸收空气中的水蒸气和二氧化碳。
②氯化钙溶液呈中性,碳酸钠溶液呈碱性。
③碳酸钠和氢氧化钙溶于水温度变化不明显。
④Ca(OH)
2分解温度为580℃,CaCO
3分解温度为825℃,Na
2CO
3的分解温度为1744℃。
【提出问题】碱石灰是否变质?其成分可能有哪些?
【进行猜想】①若没有变质,碱石灰吸水性良好,成分只有CaO和NaOH;
②若变质,该碱石灰中可能含有CaO、NaOH、Ca(OH)
2、Na
2CO
3、CaCO
3中的两种或两种以上。
【实验过程】
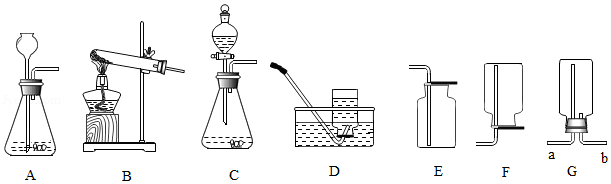
(1)验证碱石灰是否变质:图中的B为干燥装置,常用于固体干燥剂干燥气体。现用A、B装置检验碱石灰是否变质,取适量的无水硫酸铜和碱石灰样品分别装入A、B中,连接好A、B装置,从
(填“c”或“d”)端向B中缓缓通入水蒸气,观察A装置中的现象为
,证明碱石灰已变质。

(2)验证碱石灰是否完全变质:取适量碱石灰样品放入试管中,加入足量蒸馏水使其充分溶解,溶液变浑浊,用手触摸试管外壁,温度无明显变化,证明碱石灰已完全变质。则样品成分最多有
种可能性(填数字)。
(3)为进一步确定碱石灰样品的成分,该小组继续实验并记录如下:
| 编号 | 实验操作 | 实验目的、
现象或数据 | 实验结论 |
| 一 | ①取适量样品于试管中,加入
足量蒸馏水使其充分溶解;
②过滤,得到滤渣A和滤液B;
③向滤液B中加入足量CaCl2
溶液,静置;
④
| 操作③的主要目的
是
;
操作④的现象
| 样品中
一定有
Ca(OH)2 |
| 二 | ①取干燥样品50g,控制在
600℃内,加热至质量不再发生
变化,冷却后称量;
②将①中剩余固体控制在850℃
内反复加热,冷却后称量 | 操作①中称得固体
质量为45.5g;
操作②固体质量
无变化 | 样品中
一定没有
(填化学式) |
【探究结论】通过整个探究活动分析得知碱石灰样品的成分是
(填化学式),其中盐的质量分数为
。
【反思与评价】通过探究活动,大家知道了该碱石灰变质的化学反应过程,其中生成盐的化学方程式为
;明白了碱石灰要密封保存的原因。