10.小明在厨房里找到一包食用纯碱,包装袋上写有:主要成分是碳酸钠(质量分数>98%),杂质为氯化钠。
(1)为了解食用碱的溶解性,小明取三个洁净的烧杯,编号为A、B、C,分别加入40克该纯碱,再加入一定质量的水,充分溶解,得到溶液的质量如表。小明判断A烧杯所得溶液一定是该温度时碳酸钠的饱和溶液,其依据是
。
| 烧杯编号 | A | B | C |
| 加水的质量/克 | 80 | 100 | 120 |
| 溶液的质量/克 | 113 | 140 | 160 |
(2)小明接着用多种方法进行“食用纯碱中Na
2CO
3含量测定”的实验。
方法一:将一定质量的样品与足量稀盐酸反应,测定反应后生成CO
2的体积,再计算出样品中Na
2CO
3的质量。为了准确测量生成二氧化碳的体积,应在
开始用量筒收集气体。
A.实验开始时
B.有连续气泡产生时
C.先用燃着的木条检验熄灭后
D.任何时候
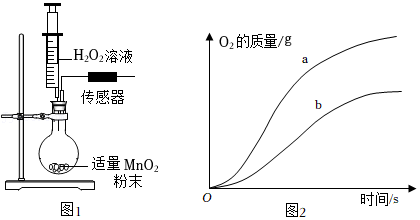
方法二:将21.5克该纯碱样品放入烧杯,加水完全溶解,将其放在电子秤上(如图甲),逐渐往杯中滴加稀盐酸,电子秤的示数与加入稀盐酸的质量关系如图乙所示。

(3)通过计算说明,该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符。(计算结果精确到0.1%)
(4)有同学认为小明测定的食用纯碱中碳酸钠的质量分数会偏大,请分析造成碳酸钠质量分数偏大的主要原因是
。




 电器的电功率由小到大
电器的电功率由小到大 金属活动性由强到弱
金属活动性由强到弱 氯元素化合价由低到高
氯元素化合价由低到高 物质的pH
物质的pH