



| A.物质性质和用途的认识 | B.对安全的认识 |
| ①小苏打能与酸反应生成气体,小苏打可制作发酵粉 ②稀有气体在通电时能发出不同颜色的光,稀有气体可制作霓虹灯 ③干冰升华时吸收大量的热,干冰常用作制冷剂 | ①硫酸铜溶液可用于游泳池水消毒,也可用于自来水消毒 ②进入枯井、菜窖前,应先做灯火实验 ③黄曲霉毒素能损害人的肝脏,诱发肝癌等疾病。因此,霉变食物绝对不能食用 |
| C.对现象的认识 | D.对元素与人体健康的认识 |
| ①气体压缩、分子变小 ②喝汽水打嗝,气体溶解度随温度升高而增大 ③活性炭除去异味,活性炭具有吸附性 | ①缺铁会引起贫血 ②缺氟易得龋齿 ③缺钙会引起甲状腺肿大 |
| 编号 | A | B | C | D |
| 实验设计 | 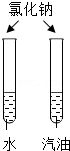 | 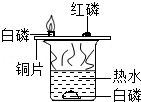 | 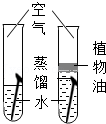 | 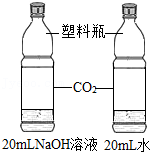 |
| 实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究可燃物燃烧的条件 | 探究铁生锈的条件 | 探究CO2与NaOH溶液能否发生反应 |
| 选项 | 实验目的 | 实验方案 |
| A | 验证某可燃性气体中含有H2 | 点燃气体,在火焰上方罩干冷烧杯,观察烧杯内壁是否出现液滴 |
| B | 测定某矿石中CaCO3 的质量分数 | 先加入硫酸,再比较反应前后的质量变化 |
| C | 检验NaOH是否变质 | 取样加水后滴加无色酚酞溶液,观察溶液颜色是否变红 |
| D | 鉴别化肥尿素[CO(NH2)2]和NH4Cl | 取样与熟石灰混合研磨,闻气味 |
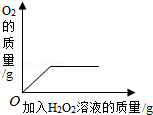 向盛有少量二氧化锰的烧杯中不断地加入过氧化氢溶液
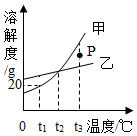
向盛有少量二氧化锰的烧杯中不断地加入过氧化氢溶液 20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体
20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体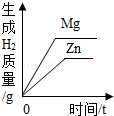 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应
等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应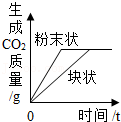 等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应
等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应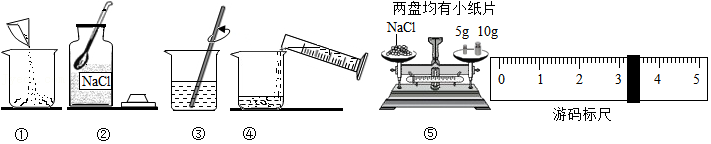
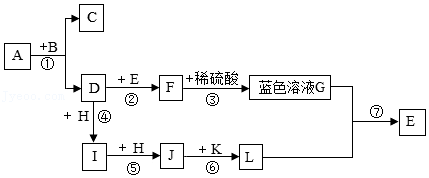
| 实验操作与现象 | 实验结论 |
| 实验操作:________ 实验现象:________ | 猜想②正确 |
| 实验组别 | 一 | 二 | 三 | 四 |
| 稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
| 混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
| 所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
| 剩余固体质量/g | 0 | 0 | m | n |