20.【科学探究】
酸雨是一种常见的环境污染问题。化学兴趣小组的同学们选择了一个下雨天,对酸雨的成因、成分和防治展开了项目式学习。
任务一:分析酸雨的成因
【查阅资料】正常雨水的pH约为5.6,而酸雨是指pH<5.6的雨、雪或其他形式的降水。常见的酸雨有硫酸型、硝酸型和混合型。
【收集证据】同学们收集了一些刚降落的雨水水样,用pH计(测量pH的仪器)每隔5分钟测定一次雨水水样的pH,其数据如下:
| 测定时间 | 15:05 | 15:10 | 15:15 | 15:20 | 15:25 | 15:30 |
| 雨水的pH | 4.95 | 4.95 | 4.94 | 4.88 | 4.86 | 4.85 |
【小组交流】
(1)正常雨水显酸性的原因是
。
(2)酸雨的形成是因为在降雨过程中,雨水溶解了空气中的
(填一种)等物质,并发生了一系列反应。在上述测定期间,雨水的酸性
(填“增强”、“减弱”或“基本不变”)。
任务二:探究酸雨的成分
【查阅资料】当地的酸雨主要含有颗粒物,Na
+、K
+、NH
4+、H
+和SO
42﹣以及少量NO
3﹣等。
【实验计划】验证酸雨中含有NH
4+和SO
42﹣。
【进行实验】同学们将收集到的酸雨按一定比例浓缩,静置,分别取少量上层清液于两支试管中,按如图所示完成下列实验。
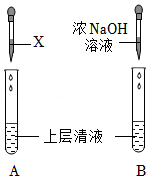
| 方案 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 向A试管中滴加几滴X | 产生白色沉淀 | 含有SO42﹣ |
| 2 | 向B试管中滴加足量浓NaOH溶液 | 有氨味 | 含有NH4+ |
【反思评价】
(3)X是
,写出其发生反应离子的离子方程式
。
(4)小明提出:若用足量浓
替代X和浓NaOH溶液,加热,只需进行一次实验即可得出最终结论,这一建议得到了其他同学的一致认可。
(5)同学们认为:酸雨中通常不含CO
32﹣,理由是
。
任务三:讨论酸雨的防治
【表达交流】酸雨的危害不容忽视,防治酸雨刻不容缓。如何防治酸雨?
(6)请提出你的一条建议:
。







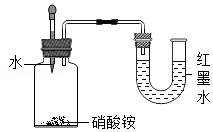 验证硝酸铵溶于水吸热
验证硝酸铵溶于水吸热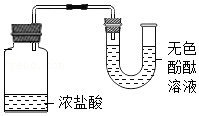 验证浓盐酸具有挥发性
验证浓盐酸具有挥发性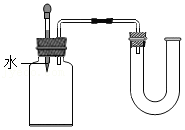 检查装置的气密性
检查装置的气密性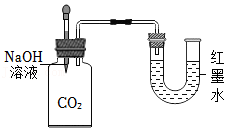 验证CO2可与NaOH反应
验证CO2可与NaOH反应