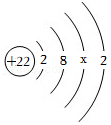
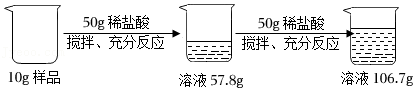
21.在进行“盐溶液与金属发生置换反应”的实验探究时,兴趣小组同学先取一定量的硫酸铜溶液于烧杯中,再切取绿豆大小的钠块投入硫酸铜溶液中,观察到钠浮在水面上,熔化成闪亮小球,有气体和蓝色沉淀生成,没有红色固体析出。充分反应后过滤,得到滤液X。
[查阅资料]①钠是银白色软金属,熔点97.81℃,沸点82.9℃,密度0.97g/cm
3②钠是一种很活泼的金属,易与空气中的O
2反应,遇水发生剧烈反应,生成NaOH和H
2。
[现象分析]
(1)钠熔成小球是因为
。
(2)生成蓝色沉淀的化学方程式为
。
[提出问题]钠与硫酸铜溶液反应后滤液X中的溶质的成分是什么?
(3)[猜想假设]猜想一:Na
2SO
4猜想二:Na
2SO
4和NaOH;猜想三:
。
[实验探究]
| 实验 | 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 取少量滤液X于试管中,观察溶液颜色 | 溶液为无色 | 猜想三不成立 |
| 实验二 | 向实验一所取的滤液中滴入氯化钡溶液 | (4)________ | 猜想一成立 |
| 实验三 | 另取少量滤液X于试管中,向其中滴加少量的无色酚酞溶液 | 溶液不变色 | 猜想一成立 |
(4)
。
(5)[反思评价]同学们认为实验二不合理,其原因
。
(6)[拓展延伸]为了用钠置换硫酸铜中的铜元素,同学们设计了如下实验方案。
方案Ⅰ:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案Ⅱ:把钠块和无水硫酸铜直接混合,隔绝空气加热。
选择合理的方案并说明理由:
。


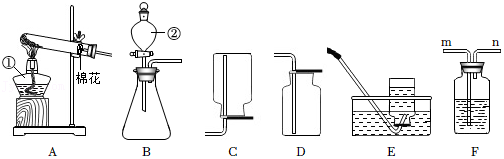
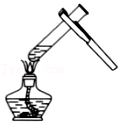 加热液体
加热液体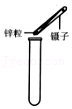 取用固体颗粒
取用固体颗粒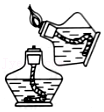 点燃酒精灯
点燃酒精灯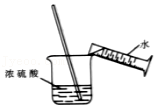 稀释浓硫酸
稀释浓硫酸
 加热一定质量氯酸钾和二氧化锰的固体混合物
加热一定质量氯酸钾和二氧化锰的固体混合物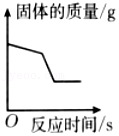 足量的锌粉与一定量的硫酸亚铁和硫酸铜的混合溶液反应
足量的锌粉与一定量的硫酸亚铁和硫酸铜的混合溶液反应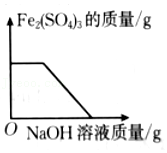 向硫酸铁和硫酸的混合溶液中,逐滴滴加NaOH溶液
向硫酸铁和硫酸的混合溶液中,逐滴滴加NaOH溶液 向一定量的盐酸和氯化钡的混合溶液中,逐渐滴加Na2CO3溶液
向一定量的盐酸和氯化钡的混合溶液中,逐渐滴加Na2CO3溶液