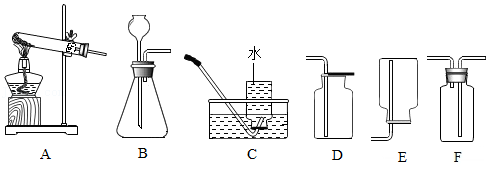
18.兴趣小组在课外实验中意外发现:将镁条放入Na
2CO
3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究1:反应产生的气体是什么?
(1)【作出猜想】小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有
三种元素,作出如下猜想:
①氢气;②二氧化碳;③氢气和二氧化碳。
【实验1】取适量镁条、100 mL Na
2CO
3溶液于反应装置A中,按如图1所示方案进行实验,B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
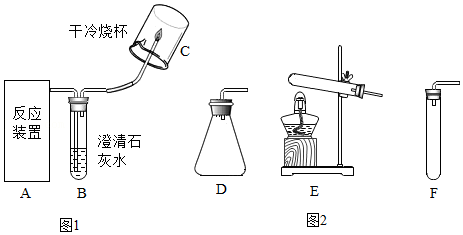
(2)反应装置A应选用图2中的
(填写序号)。
(3)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是
。
探究Ⅱ:快速产生气体的原因是什么?
【查阅资料】镁与水缓慢反应生成氢气:Na
2CO
3溶液显碱性,其溶液中除Na
+、CO
32﹣外,还有OH
﹣。
【作出猜想】可能是Na
2CO
3溶液中的某一种离子促进了镁与水的反应。
【实验2】按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是CO
32﹣而不是Na
+、OH
﹣促进了镁与水的反应。
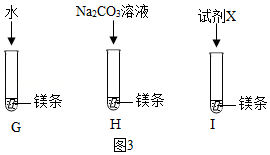
(4)G中实验的作用是
。
(5)试剂X是
。
探究Ⅲ:反应产生的白色沉淀中是否含有MgCO
3?
(6)【实验3】取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有MgCO
3.试剂Y及实验现象为
,该反应的化学方程式为
。
反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。



 合作滴加液体
合作滴加液体 检查装置气密性
检查装置气密性 加速溶解
加速溶解 手按短柄加热液体
手按短柄加热液体