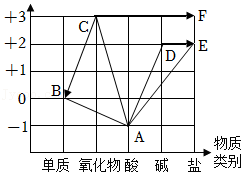
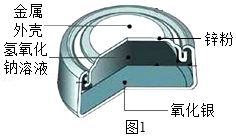
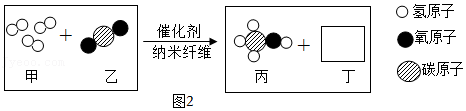
15.胆矾(CuSO
4•5H
2O,相对分子质量为250)广泛应用于生产生活中。
(1)北宋《浸铜要略序》载“山麓又胆泉(硫酸铜溶液),土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”请用方程式表示反应原理
。
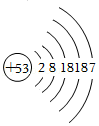
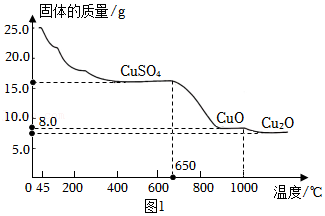
(2)某实验小组将25g胆矾放在坩埚内加热,固体质量与成分随温度变化曲线如图1所示:
资料:氧化亚铜,化学式Cu
2O,红色至红褐色结晶或粉末,不溶于水及有机溶剂,可溶于稀盐酸、稀硫酸等,在稀硫酸溶液中反应生成为二价铜和铜单质。
①加热至
℃时,CuSO
4开始分解。
实验小组的同学认为加热到1000℃以上固体产物中的物质可能是氧化铜和氧化亚铜的混合物。为了检验氧化亚铜中是否含有氧化铜,实验小组的同学展开了实验:
方案1:将反应后得到的Cu
2O样品溶于足量稀硫酸。
②甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,原因是
;甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质。
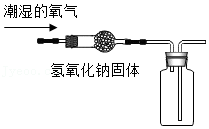
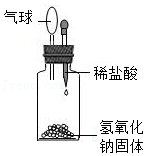
方案2:甲同学认为采用如2所示装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d(碱石灰)装置反应前后增重的质量(若氧化亚铜中混有氧化铜,则生成的水的质量不同),可计算,从而确定样品中是否含有氧化铜。
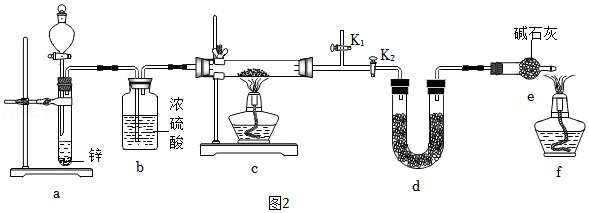
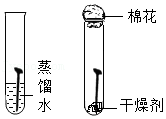
③为了使进入c装置中的气体是纯净干燥的氢气,则装置a中所加的酸是
(填化学式),装置e中碱石灰的作用是
。
④点燃装置c中酒精灯之前需进行的具体操作是
(提示:涉及到K
1、K
2的操作)。
⑤熄灭酒精灯c之后,仍需通一段时间H
2至试管冷却,原因是
。
⑥加热至1000℃时,CuO开始分解,生成Cu
2O与一种能使带火星的木条复燃的气体,该气体是
,若CuO完全分解时产生该气体的质量是多少?
(请写出计算过程)