







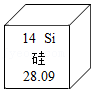
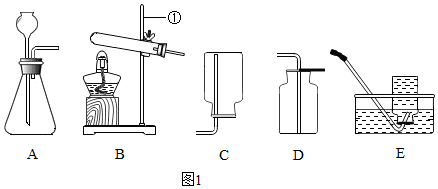
 取用固体药品
取用固体药品 倾倒液体
倾倒液体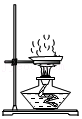 过滤
过滤 加热高锰酸钾
加热高锰酸钾| 选项 | 物质(括号内为杂质) | 方法 |
| A | CO2(HCl) | 通过足量的氢氧化钠溶液 |
| B | 碳粉(氧化铜粉末) | 加入足量的稀盐酸,过滤、洗涤、干燥 |
| C | NaNO3溶液(Na2CO3) | 加入过量的硝酸钙溶液、过滤 |
| D | 氧化钙(碳酸钙) | 加水溶解、过滤、洗涤、干燥 |

| 催化剂 |
| 光照 |
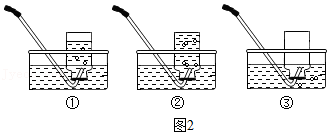
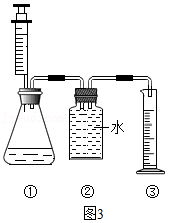
| 实验操作 | 实验现象 | 实验结论 |
| a.取少量白色固体放入烧杯中,加水溶解,取上层清液于试管中,通入CO2 | 猜想Ⅰ成立 | |
| b.另取少量白色固体放入烧杯中,加入足量稀盐酸。 | 无气泡产生 |
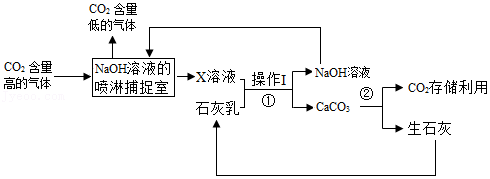
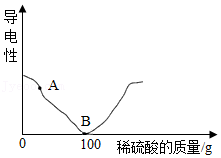
| 加入稀硫酸的质量/g | 20 | 50 | 100 | 150 |
| 产生沉淀的质量/g | 4.66 | a | 23.3 | b |