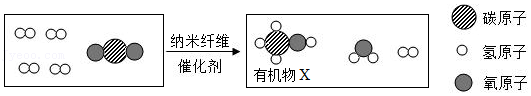
16.某实验小组在20℃时,将镁条放入饱和的Na
2CO
3溶液中,观察到持续产生较多气泡,且有白色不溶物生成。对此该小组进行如下探究。
【查阅资料】
①铁能与水缓慢反应生成氢气。
②Na
2CO
3、K
2CO
3等溶液均显碱性,其溶液中含有少量OH
﹣。
实验1:探究反应产生的气体
【猜与假设】
Ⅰ.气体是H
2Ⅱ.气体是CO
2Ⅲ.气体是H
2和CO
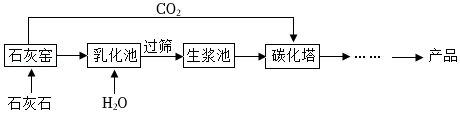
2【进行实验】取适量镁条、100mL饱和Na
2CO
3溶液,按如图所示方案进行实验。
| 编号 | 1﹣1 | 1﹣2 |
| 装置 |  | 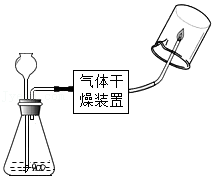 |
| 实验现象 | 澄清石灰水不浑浊 | |
【解释与结论】
(1)依据实验1﹣1、1﹣2的现象,可得出猜想1正确,则实验1﹣2的现象是
。
实验2:探究持续产生较多气体的原因
【猜想与假设】Na
2CO
3溶液中的某一种离子促进了镁与水的反应,从而产生较多气体。
猜想1:
(写离子符号)促进了反应:
猜想2:CO
促进了反应;
猜想3:OH
﹣促进了反应。
请设计实验方案验证猜想2。
【反思与评价】
(2)20℃时饱和的Na
2CO
3溶液的溶质质量分数为
(20℃时碳酸钠的溶解度为20g),某同学在20℃时将镁条放入浓度为5%的碳酸钠溶液中,观察到只有极少量气泡,由此得出的结论是
。
实验3:探究白色不溶物成分小组同学查阅资料分析得知白色不溶物可能是Mg(OH)
2和MgCO
3中的一种或两种。同学们设计以下实验方案进行验证。
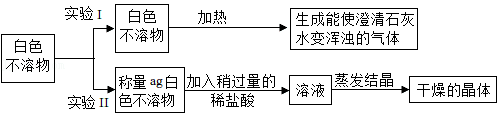
(3)根据实验Ⅰ的现象,写出加热白色不溶物时一定发生的化学反应的方程式
。
(4)实验Ⅱ结束后,称得干燥的晶体质量为m,理论上m的取值范围是
(用含a的表达式表示),证明白色不溶物是Mg(OH)
2和MgCO
3的混合物。




 浸泡
浸泡 煎熬
煎熬 去渣
去渣 装瓶
装瓶 取盐
取盐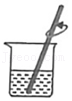 溶解
溶解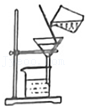 过滤
过滤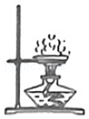 蒸发
蒸发