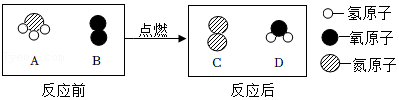
20.铜、铁是人类使用最早、应用广泛的金属。
【探究一】
(1)铁生锈主要跟空气中的
有关,用稀硫酸除铁锈的化学方程式为
。
(2)小茜同学发现自己的铜制眼镜框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称“铜绿”,主要成分为Cu
2(OH)
2CO
3,该反应的化学方程式为:2Cu+O
2+H
2O+X═Cu
2(OH)
2CO
3,则X的化学式为
。
【探究二】
以黄铜矿(CuFeS
2)为原料,采用生物炼铜是现代炼铜的新工艺,原理为:
4CuFeS
2+17O
2+2H
2SO
44CuSO
4+2Fe
2(SO
4)
3+2H
2O,向上述反应后的溶液中加入Fe粉,得到FeSO
4溶液和Cu。
(3)CuFeS
2为二硫化亚铁铜,也可以表示为CuS•FeS,其中S元素的化合价为
。
(4)发生主要反应的两个化学方程式为:①Fe+Fe
2(SO
4)
3=3FeSO
4; ②
。
(5)FeSO
4溶液经蒸发浓缩、
、过滤等操作得到硫酸亚铁晶体(FeSO
4•xH
2O)。
【探究三】
硫酸亚铁晶体(FeSO
4•xH
2O)是一种重要的食品和饲料添加剂,对其进行热分解研究。
【查阅资料】①硫酸铜粉末为白色,吸水后变成蓝色晶体。
②二氧化硫能使高锰酸钾溶液褪色
③硫酸亚铁晶体加热会先失去结晶水,高温会继续分解产生一种金属氧化物和两种非金属氧化物。

称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B的质量测出x的值。
(6)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有
,装置C中高锰酸钾溶液褪色,说明产物中还有
;装置D球形干燥管的作用
;实验中要持续通入氮气,否则测出的x会
(填“偏大”、“偏小”或“不变”)。
(7)硫酸亚铁晶体完全分解后,装置A中残留红棕色固体,另从理论上分析得出硫酸亚铁分解还生成另一物质SO
3,写出FeSO
4分解的化学方程式
。
(8)某研究所利用热分析仪对硫酸亚铁晶体(FeSO
4•xH
2O)进行热分解,获得相关数据,绘制成固体质量﹣﹣分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO
4•xH
2O中的x=
。




 称取固体
称取固体 量取液体
量取液体 过滤
过滤 蒸发
蒸发
 向一定量的稀盐酸和氯化钙混合溶液中不断滴入碳酸钠溶液至过量
向一定量的稀盐酸和氯化钙混合溶液中不断滴入碳酸钠溶液至过量 给氯酸钾和二氧化锰的混合物加热制氧气
给氯酸钾和二氧化锰的混合物加热制氧气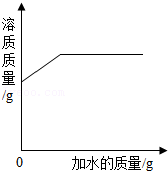 向饱和的氯化钠溶液中不断加水
向饱和的氯化钠溶液中不断加水 等质量的锌、铁与足量的相同溶质质量分数的稀硫酸反应
等质量的锌、铁与足量的相同溶质质量分数的稀硫酸反应