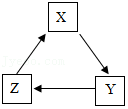
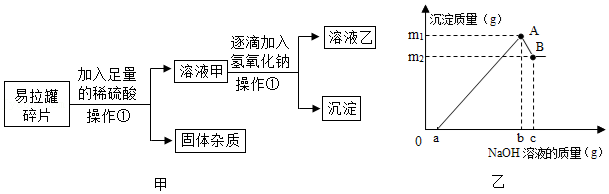
10.小明在厨房里找到一包食用纯碱,包装带上写有:主要成分是碳酸钠(质量分数≥98%),杂质为氯化钠。他利用该纯碱进行如下实验:
(1)为了解食用纯碱的溶解性。小明取三个洁净的烧杯,编号为A、B、C,分别加入40克该纯碱。再加入一定质量的水。充分溶解,得到溶液的质量如表。小明判断C烧杯所得溶液一定是该温度时碳酸钠的不饱和溶液、其依据是
。
| 烧杯编号 | A | B | C |
| 加水的质量/克 | 80 | 100 | 120 |
| 溶液的质量/克 | 113 | 140 | 160 |
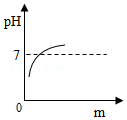
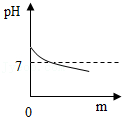
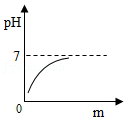
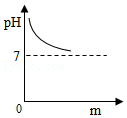
(2)小明另取一个洁净的烧杯D,将32克该纯碱样品放入其中,加水完全溶解。将其放在电子秤上(如图甲),逐渐往杯中滴加稀盐酸。电子秤的示数与加入稀盐酸的质量关系如图乙所示。碳酸钠与盐酸反应的化学方程式为Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑。
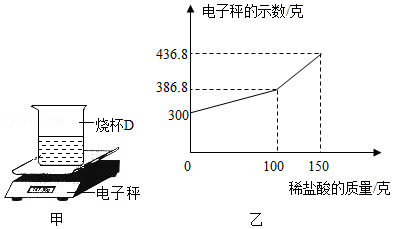
①通过计算说明,该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符
。(计算结果精确到0.1%)
②有同学认为小明测定的食用纯碱中碳酸钠的质量分数会偏大,请分析造成碳酸钠质量分数偏大的主要原因是
。



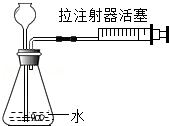 检查气密性
检查气密性 制气
制气 收集
收集 验满
验满