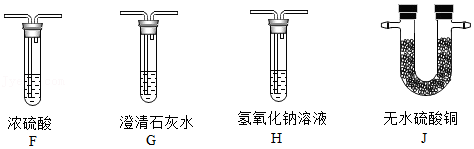
17.已知Mg能在CO
2中燃烧,根据金属活动性顺序表,Na的金属活动性比Mg强,说明Na也能在CO
2中燃烧。为了验证,实验小组进行了以下实验探究:
(查阅资料)
①金属钠性质活泼,常温下,金属钠极易与氧气反应,生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠。金属钠还可以与水剧烈反应,放出氢气。
②Na
2CO
3溶液显碱性;CaCl
2溶液显中性。
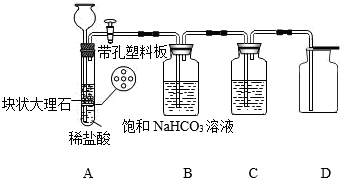
(实验探究一)
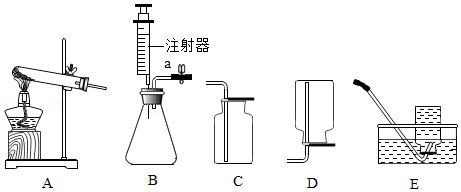
步骤1:打开活塞,让A装置中产生的气体依次通过B、C,收集一瓶纯净干燥的CO
2气体。
步骤2:将燃烧的钠迅速伸入集气瓶中,观察到钠在CO
2中继续燃烧,发光放热,冷却后观察到瓶内附着黑色颗粒,并粘附着白色物质。
(问题讨论)
(1)为获得纯净的CO
2,可利用装置B除去CO
2中混有的
;装置C中盛放的试剂是
。
(2)步骤2中生成的黑色固体成分是
。
(初步结论)Na能在CO
2中燃烧。
(提出问题)白色物质是什么?
(猜想与假设)
猜想一:氧化钠;
猜想二:碳酸钠;
猜想三:氧化钠和碳酸钠的混合物;
猜想四:氢氧化钠。
(3)大家讨论后一致认为猜想四是错误的,理由是
。
(实验探究二)
(4)对白色物质是什么进行实验探究,方案设计如下:
方案1:取该样品少量于试管中,加入适量的水。振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色。
结论:白色物质中一定有氧化钠。
方案2:取该样品少量于试管中,滴加足量盐酸,溶液中有气泡冒出。
结论:白色物质中一定有
(填化学式)。
方案3:取该样品少量于试管中,加入适量的水,振荡,过滤,向滤液中加入过量的氯化钙溶液,出现白色沉淀,过滤,再向滤液中滴加无色酚酞溶液,无明显现象。
(反思与评价)
(5)甲同学思考后提出方案1得出的结论不正确,其理由是
。
(6)方案3中加入过量CaCl
2溶液的目的是
。写出此反应的化学方程式
。
(实验结论)
(7)综上所述,你认为猜想
成立。
(8)请写出Na在CO
2中燃烧的化学方程式
。