20.实验室有一包NaCl样品,可能混有的杂质为NaOH、Na
2CO
3中的一种或两种。化学兴趣小组为确定样品的成分,进行以下实验。
(1)【探究一】测量样品溶液的pH。
取少量样品溶于水,测得溶液的pH大于7。小组同学对样品的成分进行猜想,猜想一:含有
;猜想二:含有NaCl和NaOH;猜想三:含有NaCl、NaOH和Na
2CO
3。
(2)【探究二】测量样品与硫酸反应生成气体的体积。
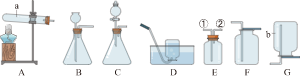
如图1所示,取3.00g样品与足量稀硫酸混合,充分反应后,测得生成气体的体积为220mL(该条件下气体的密度为2.00g/L;装置气密性良好且忽略气体的溶解)。集气瓶上方加入一层植物油的目的是
。
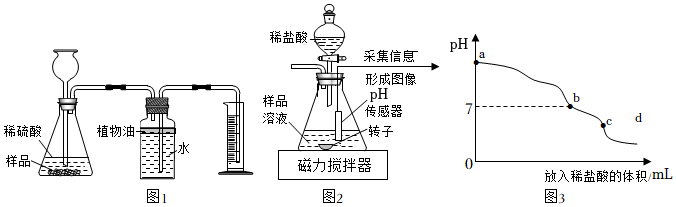
【探究三】测量样品与盐酸反应后氯化钠的质量。
如图2所示,另取3.00g样品置入锥形瓶中,加适量水溶解。逐滴加入过量的稀盐酸,用pH传感器等电子设备采集信息形成图像如图3。将锥形瓶中最终所得溶液蒸发、结晶得到全部固体,其质量为3.48g。
(3)c点溶液呈
(填“酸性”、“碱性”或“中性”)。
(4)ab段溶液pH降低,可能发生反应的化学方程式为
(写一个即可)。
(5)蒸发时除使用蒸发皿、铁架台(带铁圈)外,还需要用到的仪器有
。
(6)【实验结论】关于样品的成分,猜想
(填“一”、“二”或“三”)是正确的。
(7)【定量计算】结合探究二、三,计算样品中氯化钠的质量分数(精确到0.1%)。
(8)【交流反思】下列因素会导致所测样品中氯化钠的质量分数偏小的是
(填序号)。
A.探究二中俯视读取量筒中水的体积
B.探究二实验后生成气体在锥形瓶中仍有滞留
C.探究三中加入的稀盐酸量不足
D.探究三中蒸发时有液体溅出