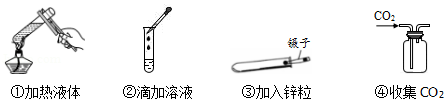
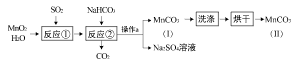
30.某校九年级“我们爱化学”活动小组的同学,在探究碱的化学性质时,完成了如图所示的A、B两个实验。请你回答下列问题:

(1)A实验中酚酞的作用是
,所发生的化学反应方程式为
。
(2)B实验中可观察到的现象是
。
(3)实验后,将两支试管中的废液都倒入废液杯C中,发现混合废液浑浊并显红色。
【分析思考】同学们经过思考一致认为,混合废液显红色是B实验后试管中的溶质与A实验后试管中的酚酞反应的结果。
【提出问题】B实验后试管中的溶质是什么?
【作出猜想】猜想一:试管中的溶质是NaOH;猜想二:试管中的溶质是
;
猜想三:试管中的溶质是Ca(OH)
2和NaOH。
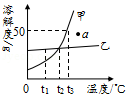
【实验验证】华雪同学利用废液杯C中的混合废液来确定B实验后试管中的溶质:将一定质量的废液过滤,取10g滤液并向其中逐滴加入质量分数为7.3% 的稀盐酸,当加入稀盐酸的质量为20g时反应完全,继续加入稀盐酸,气体的质量不再增加,根据反应现象得到如图所示的图象。
【查阅资料】碳酸钠溶液与稀盐酸的反应是分步进行的。首先是碳酸钠与稀盐酸反应生成碳酸氢钠和氯化钠:Na
2CO
3+HCl═NaHCO
3+NaCl;然后是生成的碳酸氢钠与稀盐酸反应生成氯化钠、二氧化碳气体和水:NaHCO
3+HCl═NaCl+CO
2↑+H
2O。
【实验结论】定性结论:分析图象得出:猜想二是正确的,产生的气体是
(填化学式);猜想一和猜想三是错误的,原因是
。
定量结论:10g废液中含有
g NaOH,
g Na
2CO
3。
【拓展提升】请另外设计一个实验,定性证明上述猜想二是正确的:
。