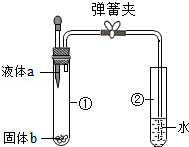
稀释浓硫酸
稀释浓硫酸 取少量固体粉末
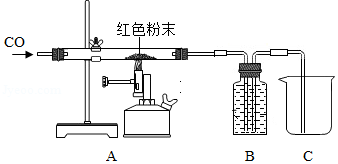
取少量固体粉末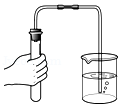 检验装置的气密性
检验装置的气密性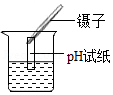 测溶液pH
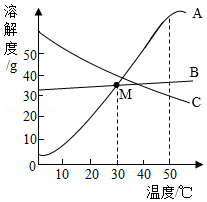
测溶液pH| 液体 | 胃液 | 唾液 | 胆汁 | 胰液 |
| pH | 0.9﹣1.5 | 6.6﹣7.1 | 7.1﹣7.3 | 7.5﹣8.0 |

| 实验目的 | 实验设计 | |
| A | 鉴别空气、氧气、二氧化碳 | 燃着的木条分别伸入集气瓶 |
| B | 区分氢氧化钠溶液和碳酸钠溶液 | 分别滴加无色酚酞溶液 |
| C | 鉴别稀盐酸和稀硫酸 | 分别滴加BaCl2溶液 |
| D | 鉴别稀盐酸和澄清石灰水 | 分别滴加紫色石蕊溶液 |
| 物质 | 甲 | 乙 | 丙 | 丁 |  |
| 微观示意图 |  |  |  |  |
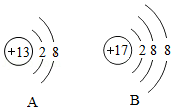
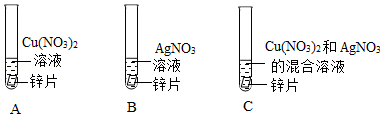
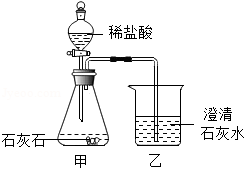
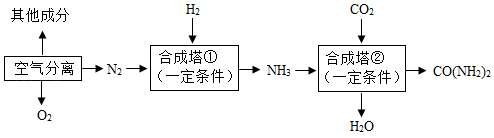

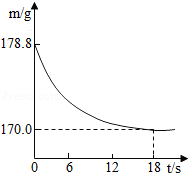
| 1 |
| 5 |
| 实验方案 | 实验现象 | 实验结论 |
| 取少量红色粉末放入试管中,滴加足量的稀盐酸振荡 | 红色粉末全部消失,溶液呈棕黄色 | 粉末为Fe2O3 |
| Cu粉 |