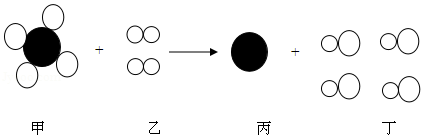
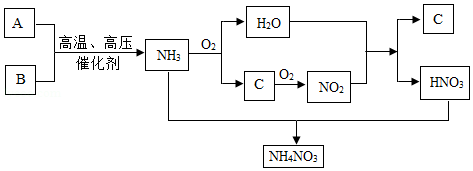
30.某校九年级“我们爱化学”活动小组的同学,探究了过氧化钠(Na
2O
2)与二氧化硫(SO
2)反应后所得固体产物的成分,过程如下:
【查阅资料】过氧化钠与二氧化硫反应的化学方程式为:2SO
2+2Na
2O
2=2Na
2SO
3+O
2,2Na
2SO
3+O
2=2Na
2SO
4;SO
2能使品红溶液褪色。
【提出猜想】猜想1:固体成分为Na
2SO
3 猜想2:固体成分为Na
2SO
4 猜想3:
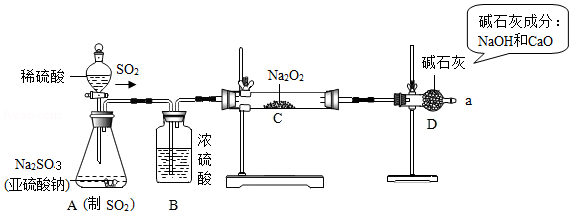
【实验探究】用如图所示的装置进行实验。打开A中分液漏斗的活塞,反应发生(产生足量的SO
2)后,用带火星的木条检验从a处导出的气体,木条复燃。实验前称得Na
2O
2固体的质量为78g,充分反应后称得生成物固体的质量为134g。
【实验结论】(1)A是制取SO
2气体的装置,反应的化学方程式与实验室制取CO
2的化学方程式类似,请写出A中发生反应的化学方程式:
。
(2)由题中
的实验现象,可推测猜想2是错误的。
(3)装置B的作用是
;装置D的作用是
。
(4)根据反应前后固体的质量,可计算出Na
2SO
3的质量为
g,Na
2SO
4的质量为
g。
【总结提升】(1)若实验前称得Na
2O
2固体的质量为m
1g,充分反应后称得生成物固体质量为m
2g,则m
2的取值范围是
(用含m
1的关系式表示)
(2)请另外设计一种实验方案,定性验证过氧化钠与二氧化硫反应后所得固体产物的成分:




 检查气密性
检查气密性 熄灭酒精灯
熄灭酒精灯 吸取液体
吸取液体 滴加液体
滴加液体