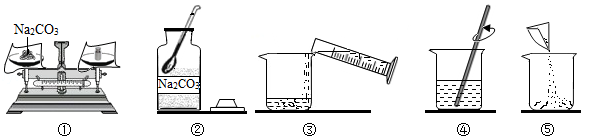
29.某化学兴趣小组在实验室发现一瓶混入Na
2CO
3的NaOH固体。于是他们对该固体中Na
2CO
3的含量进行探究。
【查阅资料】Ⅰ.碱石灰是氢氧化钠与氧化钙的固体混合物。
Ⅱ.无水硫酸铜是一种白色固体,遇水会变成蓝色。
【提出问题】该固体中Na
2CO
3的质量分数是多少?
【反应原理】碳酸钠与稀硫酸反应会生成CO
2,反应的化学方程式为
。
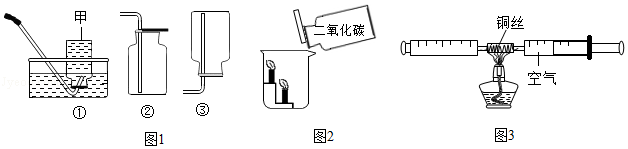
【制定计划】同学们设计了两种实验方案(装置气密性良好,浓硫酸、碱石灰均足量)。
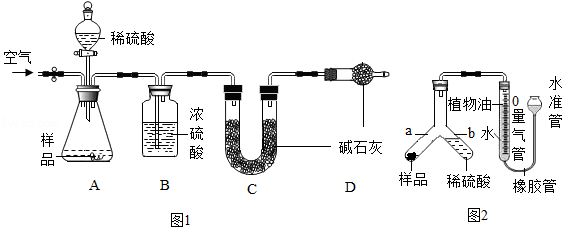
方案甲:用图1所示装置测定反应后生成CO
2的质量。称取一定质量的样品于锥形瓶中,通入一段时间空气后,向样品中滴加稀硫酸,待样品反应完全,继续通入一段时间空气后,测出生成CO
2的质量,计算。
方案乙:用图2所示装置测定反应生成CO
2的体积。称取一定质量的样品,将样品和足量稀硫酸分别置于Y形管a、b处(此时量气管液面在零刻度处),倾斜Y形管,使反应发生,待样品反应完全,测出生成CO
2的体积,计算。
【分析与讨论】
(1)方案甲中,浓硫酸的作用是
;为测出生成CO
2的质量,需要在样品反应前后分别称量装置
(填装置序号)的质量。方案乙中,植物油的作用是
;反应结束后,应
,然后根据液面读出生成CO
2的体积。
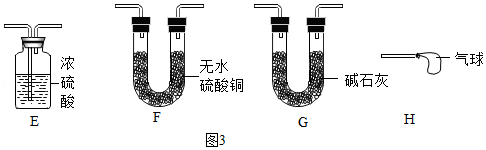
(2)小红同学认为方案甲的装置设计还存在一个明显缺陷,可增加图3中的一个装置进行改进,改进后整套装置的连接顺序为
(按气流方向填装置序号)。
(3)小青同学认为,还可以用“沉淀法”进行测定:称取一定质量的样品放入试管中,
,计算。
【进行实验】同学们在完善实验方案后,测出了该NaOH固体中Na
2CO
3的质量分数。
【反思与评价】设计实验方案应使实验简便、误差小。




 闻气味
闻气味 滴加蒸馏水
滴加蒸馏水 引燃酒精灯
引燃酒精灯 装入MnO2粉末
装入MnO2粉末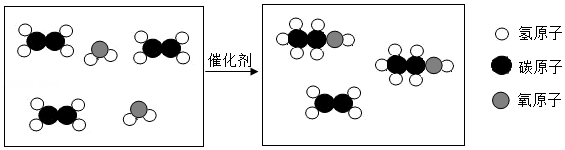
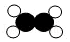 和
和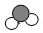 分子个数比是3:2
分子个数比是3:2