16.在实验室中常用二氧化锰和浓盐酸共热制取氯气,反应的化学方程式为:MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
请回答下列问题:
Ⅰ.Cl
2的制备
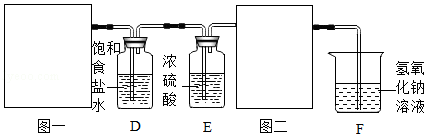
(1)根据实验室制备Cl
2的反应原理,图一中应选用的发生装置是
(填字母)。
(2)为获得纯净的氯气,可利用装置D除去Cl
2中混有的
;装置E中浓硫酸的作用是
。若将浓硫酸滴到白纸上,现象是
。
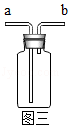
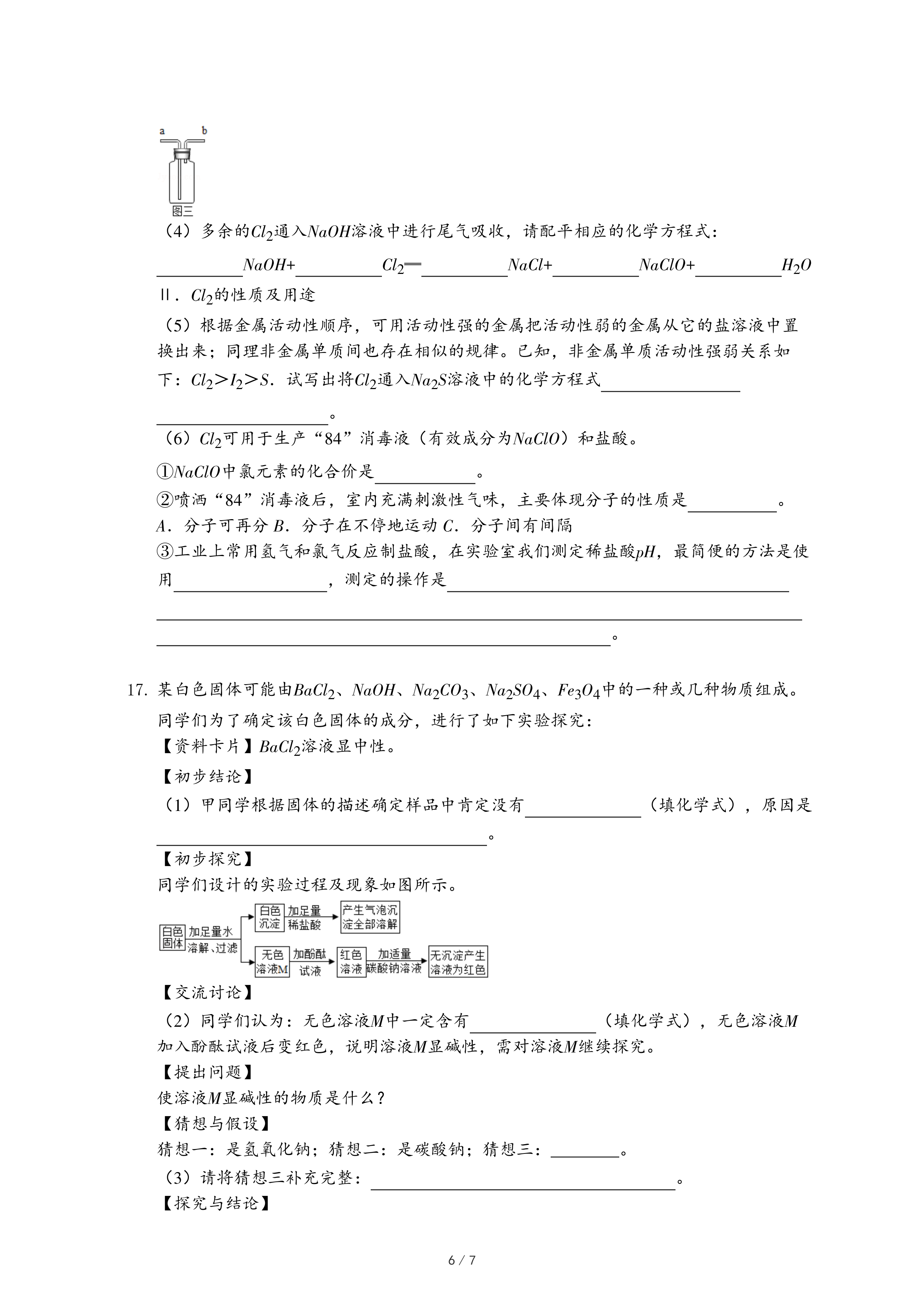
(3)图二的装置用于收集Cl
2,则气体应从图三中的
(填“a”或“b”)进入。
(4)多余的Cl
2通入NaOH溶液中进行尾气吸收,请配平相应的化学方程式:
NaOH+
Cl
2═
NaCl+
NaClO+
H
2O
Ⅱ.Cl
2的性质及用途
(5)根据金属活动性顺序,可用活动性强的金属把活动性弱的金属从它的盐溶液中置换出来;同理非金属单质间也存在相似的规律。已知,非金属单质活动性强弱关系如下:Cl
2>I
2>S.试写出将Cl
2通入Na
2S溶液中的化学方程式
。
(6)Cl
2可用于生产“84”消毒液(有效成分为NaClO)和盐酸。
①NaClO中氯元素的化合价是
。
②喷洒“84”消毒液后,室内充满刺激性气味,主要体现分子的性质是
。
A.分子可再分 B.分子在不停地运动 C.分子间有间隔
③工业上常用氢气和氯气反应制盐酸,在实验室我们测定稀盐酸pH,最简便的方法是使用
,测定的操作是
。



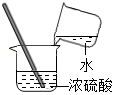 稀释浓硫酸
稀释浓硫酸 夹持蒸发皿
夹持蒸发皿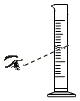 量筒体积读数
量筒体积读数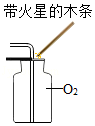 O2验满
O2验满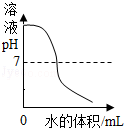 向一定浓度的NaOH溶液中加水稀释
向一定浓度的NaOH溶液中加水稀释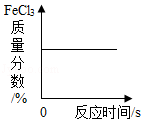 FeCl3催化H2O2溶液的分解
FeCl3催化H2O2溶液的分解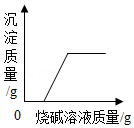 向硫酸和硫酸铜的混合溶液中逐滴加入烧碱溶液至过量
向硫酸和硫酸铜的混合溶液中逐滴加入烧碱溶液至过量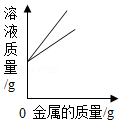 等质量的铁、锌分别与等质量分数的足量稀硫酸反应
等质量的铁、锌分别与等质量分数的足量稀硫酸反应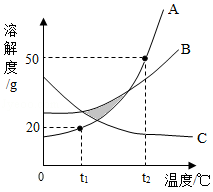


 ”的相对原子质量是“”的
”的相对原子质量是“”的 n倍,该反应中“
n倍,该反应中“ ”和“
”和“ ”的质量比是 (用含n的式子表示)。
”的质量比是 (用含n的式子表示)。