



 倾倒液体
倾倒液体 读取液体体积
读取液体体积 稀释浓硫酸
稀释浓硫酸 检查装置气密性
检查装置气密性
| 实验目的 | 实验方法 | |
| A | 除去CO中混有的少量CO2 | 通过灼热的氧化铜粉末 |
| B | 除去O2中混有的H2O | 将气体通过氢氧化钠溶液 |
| C | 除去KCl中混有的MnO2 | 加足量水溶解,过滤,蒸发结晶 |
| D | 除去KNO3溶液中混有的K2CO3 | 加入足量稀盐酸,充分反应后,蒸发结晶 |
| 实验次数物质质量 | 第1次 | 第2次 | 第3次 |
| 加入稀盐酸的质量/g | 20 | 20 | 20 |
| 充分反应后剩余固体的质量 | 2.6 | 1.2 | 0.1 |

| A。保护金属资源 | B。归纳物质性质 |
| ①有计划、合理开采金属矿物②加强金属制品的回收再利用③钢铁表面刷上油漆,防止钢铁生锈 | ①汽油、洗涤剂都能溶解油污②铁丝、红磷都能在空气中燃烧③氢气、一氧化碳都能还原氧化铜 |
| C。关注实验安全 | D。鉴别常见物质 |
| ①不能把鼻孔凑到容器口闻药品②不能用手接触药品③不能尝任何药品的味道 | ①区分氯酸钾和高锰酸钾:观察颜色②区分硬水和软水:加肥皂水后搅拌③区分过氧化氢溶液和水:加入MnO2观察现象 |

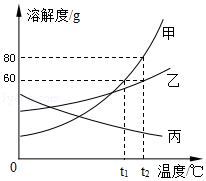



| 实验操作 | 实验现象、分析或结论 | |
| 实验一 | 步骤一:取少量硫酸铜晶体放在研钵内观察 | 现象:晶体为蓝色 |
| 步骤二:用研杵将硫酸铜晶体研碎。 | 现象: 。 | |
| 步骤三:在2支试管中分别放入少量研碎前、后的硫酸铜晶体,并加入少量水,振荡得到澄清的硫酸铜溶液。 | 现象:研碎后的硫酸铜晶体溶解的更快。分析:原因是 。 | |
| 步骤四:向上述两支试管中各滴加少量氢氧化钠溶液。 | 现象:2支试管中均有蓝色不溶物生成。分析:(1)该反应的化学方程式是 ;(2)该对比实验得出的实验结论是 。 | |
| 实验二 |  用木炭还原氧化铜 用木炭还原氧化铜 | 现象:有部分黑色粉末变红,澄清石灰水变浑浊。分析:(1)粉末由黑色变成红色的过程中发生化学反应的化学方程式是 ;(2)上述现象说明木炭和氧化铜发生了化学变化。 |
| 阴离子阳离子 | OH﹣ | NO3﹣ | Cl﹣ | SO42﹣ | CO32﹣ |
| K+ | 甲 | 乙 | 丙 | ||
| Ba2+ | 丁 | 戊 |

| 步骤一 | 步骤二 | 步骤三 | |
| 假设一 | 有白色沉淀生成 | ||
| 假设二 | 无白色沉淀生成 | 溶液变红 | 溶液变为无色 |
| 假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |