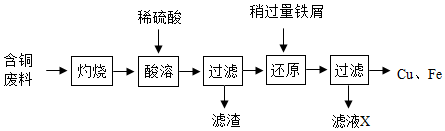
16.碳酸氢钠是一种应用广泛的盐,化学小组对其进行了探究。
(1)NaHCO
3可称为钠盐或碳酸氢盐,它是由Na
+和
(填离子符号)构成,医疗上能用于治疗胃酸(含有盐酸)过多症,反应的化学方程式为
。
【提出问题】实验室中如何制取少量NaHCO
3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH
3+CO
2+H
2O═NaHCO
3↓+NH
4Cl;2NaHCO
3Na
2CO
3+CO
2↑+H
2O。
材料二:研究发现,NaHCO
3溶于水时吸收热量,Na
2CO
3溶于水时放出热量。
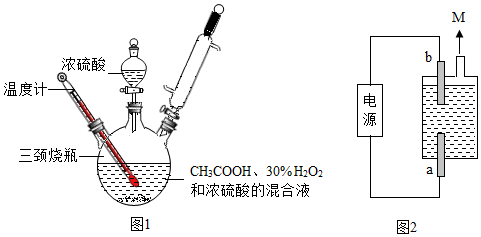
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO
3。
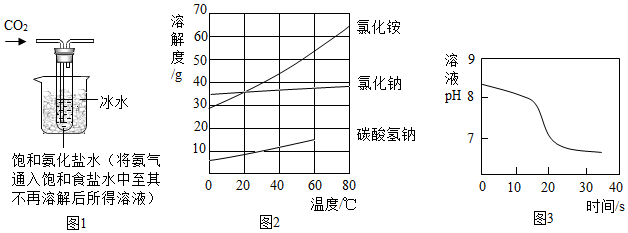
反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是
。
(3)能进一步确认该白色固体是NaHCO
3的实验方案是
(须用到的仪器和药品:试管、温度计、水)。
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是
。
【性质探究】
常温下,取一定量的NaHCO
3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl
2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料三NaHCO
3溶于水后,少量的HCO
3﹣能同时发生如下变化:
变化①:HCO
3﹣+H
2O→H
2CO
3+OH
﹣;
变化②:HCO
3﹣→CO
32﹣+H
+。
材料四:溶液的酸碱性与溶液中H
+和OH
﹣数目的相对大小有关。常温下,当单位体积溶液中OH
﹣的数目大于H
+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H
+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO
3溶液显
(填“酸”“碱”或“中”)性,结合材料三、四从微观角度说明原因:
。
(6)根据本实验,下列说法错误的是
(填字母)。
a.pH<6.68时生成的无色气体为CO
2b.从0~30s,单位体积溶液中H
+数目不断增大
c.不能用CaCl
2溶液鉴别Na
2CO
3和NaHCO
3溶液






 溶解粗盐
溶解粗盐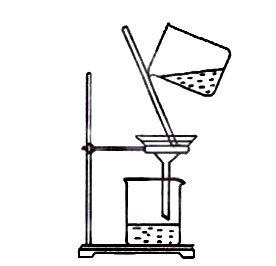 过滤食盐水
过滤食盐水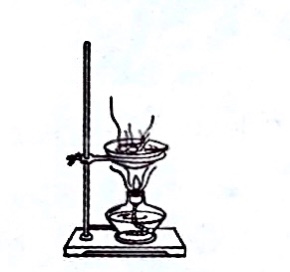 蒸发食盐水
蒸发食盐水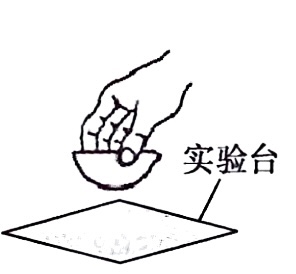 冷却蒸发皿
冷却蒸发皿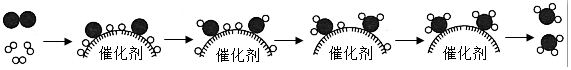
 表示氢气分子
表示氢气分子