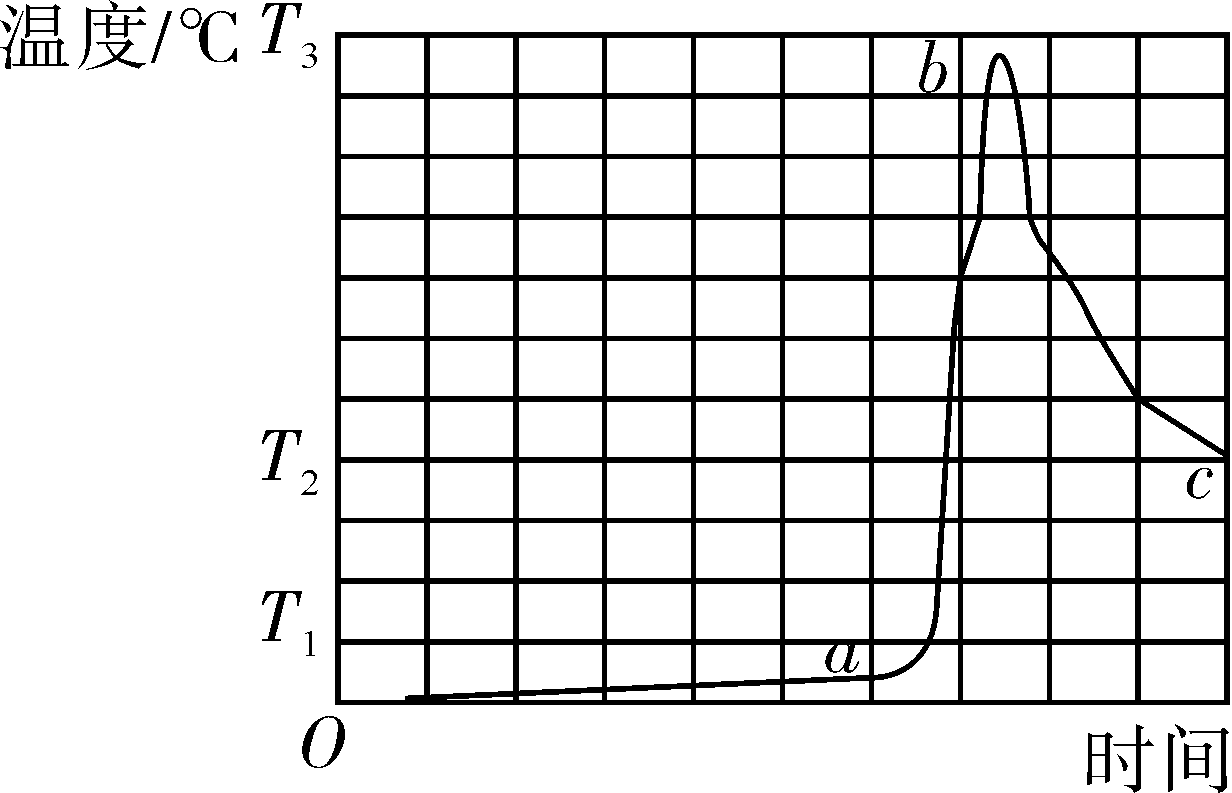
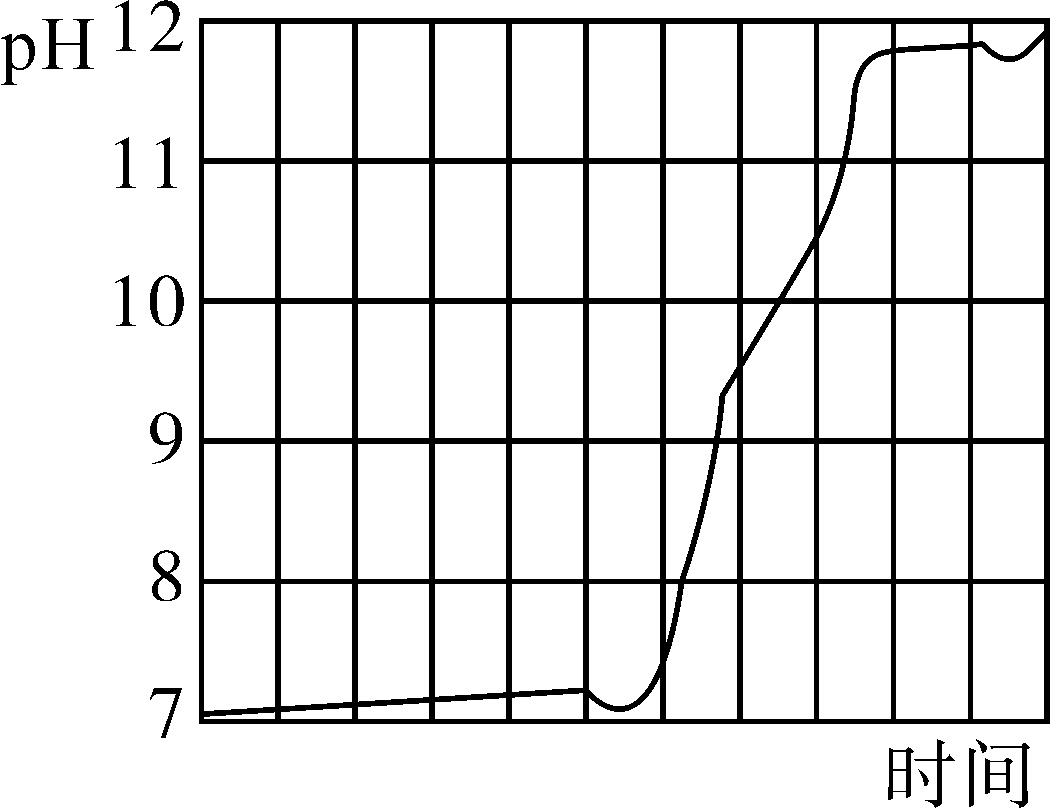
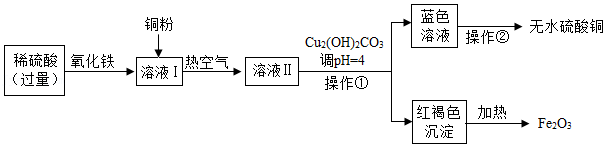
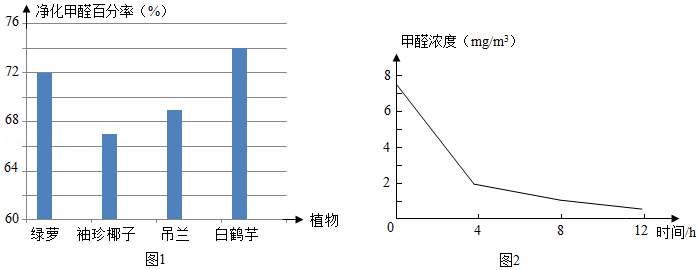
21.FeCO
3能用于制备可溶性乳酸亚铁补血剂。某化学兴趣小组对其制备和性质进行了如下探究。
【查阅资料】
1、溶液pH大于8.8时,Fe
2+完全转化为Fe(OH)
2沉淀
2、FeCO
3固体置于潮湿的空气中易变质生成Fe(OH)
33、FeCl
3溶液中滴加KSCN溶液,会出现血红色絮状物;而FeCl
2溶液中滴加KSCN溶液,不会出现血红色絮状物
4、FeCO
3是白色固体,难溶于水,能与酸反应,与稀盐酸反应的化学方程式为:FeCO
3+2HCl═FeCl
2+H
2O+CO
2↑
5、碱石灰的主要成分是NaOH和CaO
探究一:FeCO
3的制备
(1)该兴趣小组用pH=11.9的Na
2CO
3溶液和FeSO
4溶液在烧杯中制备FeCO
3时,应选用的加料方式是
(填字母)。
A、将FeSO
4溶液与Na
2CO
3溶液同时加入到烧杯中
B、将FeSO
4溶液缓慢加入到盛有Na
2CO
3溶液的烧杯中
C、将Na
2CO
3溶液缓慢加入到盛有FeSO
4溶液的烧杯中
(2)制备FeCO
3的化学方程式为
。
探究二:FeCO
3的性质探究
【提出问题】久置于空气中的FeCO
3固体的成分是什么呢?
(3)【猜想与假设】猜想1:FeCO
3猜想2:FeCO
3和Fe(OH)
3猜想3:
(4)【定性探究】
| 实验操作 | 实验现象 | 结论 |
| 取少量固体于试管中,加入足量的稀盐酸 | 固体完全溶解,有气泡产生 | ① ________不成立 |
| 取少量上述反应后的溶液于试管中,滴加KSCN溶液 | ②________ | 猜想2成立 |
①
不成立;
②
。
【实验结论】久置于空气中的FeCO
3固体的成分是FeCO
3和Fe(OH)
3。
【定量探究】该兴趣小组为进一步确定固体中FeCO
3的质量分数,称取10.0g固体做了如图所示的补充实验。
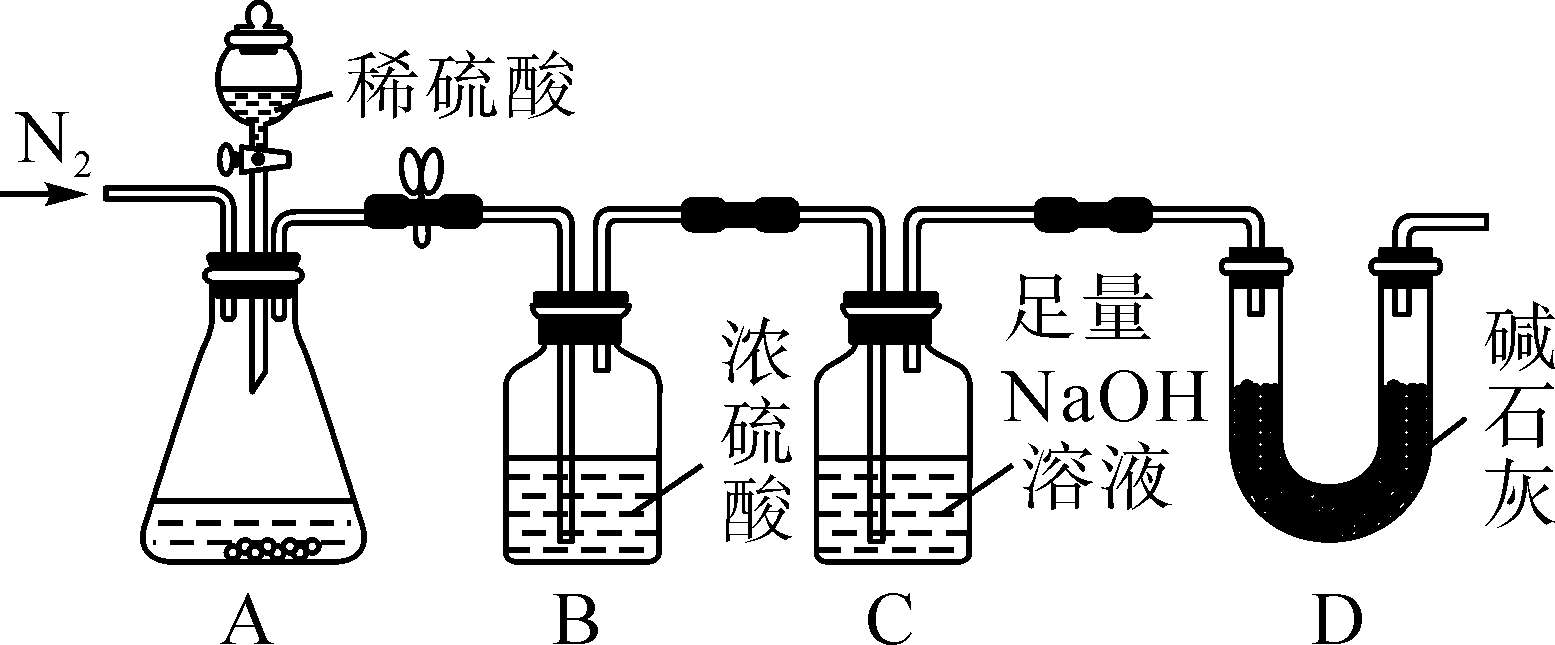
(5)装置C中足量NaOH溶液的作用是
。(用化学方程式表示)。
(6)反应结束后,继续通入一段时间N
2的目的是
。
(7)关于上述实验过程,下列说法不正确的是
。
A、装置A中加入的稀硫酸可用稀盐酸代替
B、装置B的作用是除去水蒸气
C、如果去掉装置D,会使实验结果偏大
D、实验结束后,测得装置C增重0.44g,则固体中FeCO
3的质量分数为11.6%




 闻气味
闻气味 二氧化碳验满
二氧化碳验满 浓硫酸稀释
浓硫酸稀释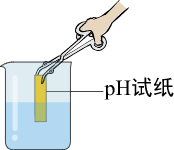 测定溶液pH
测定溶液pH


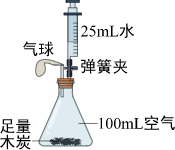
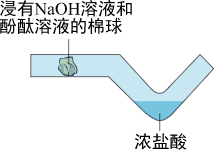
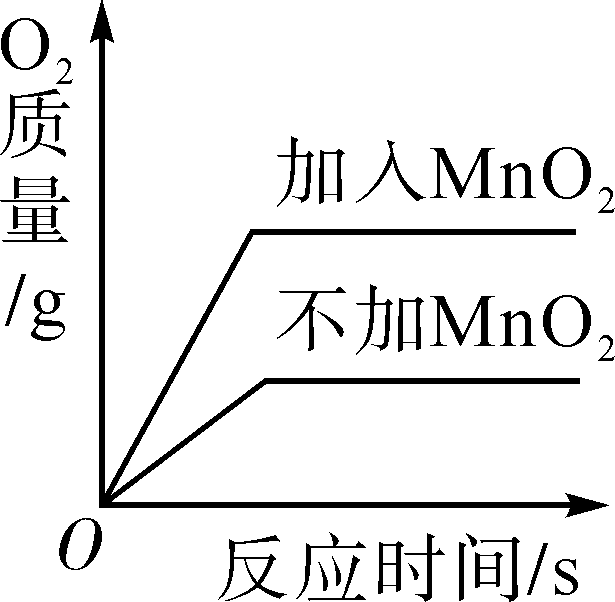 用两份等质量的氯酸钾制取氧气
用两份等质量的氯酸钾制取氧气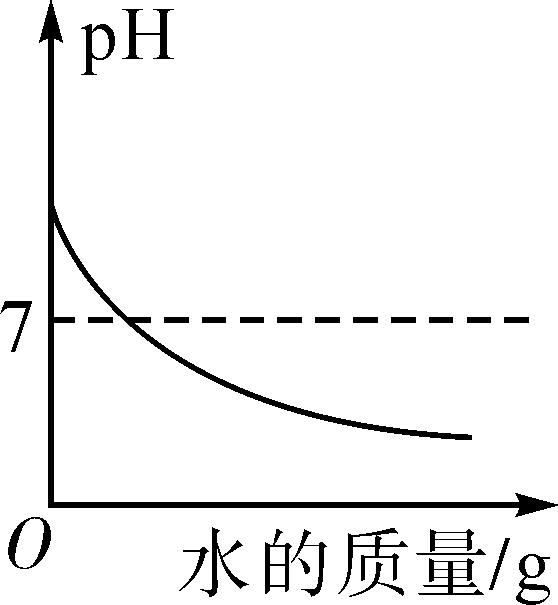 向一定量的氢氧化钠溶液中滴加水
向一定量的氢氧化钠溶液中滴加水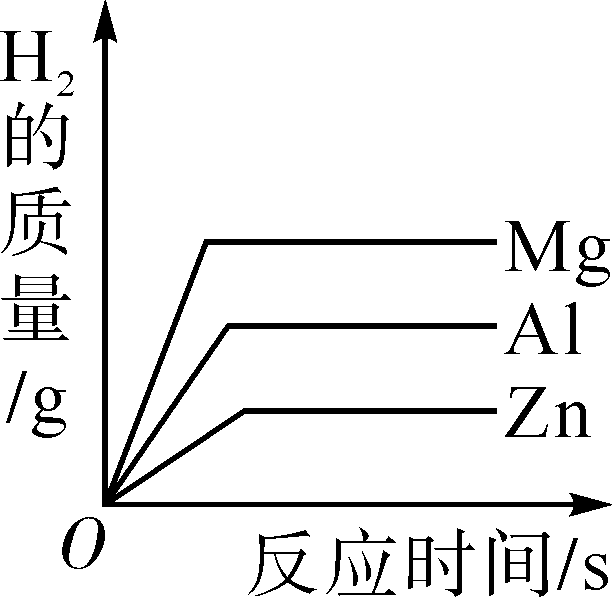 向足量相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
向足量相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉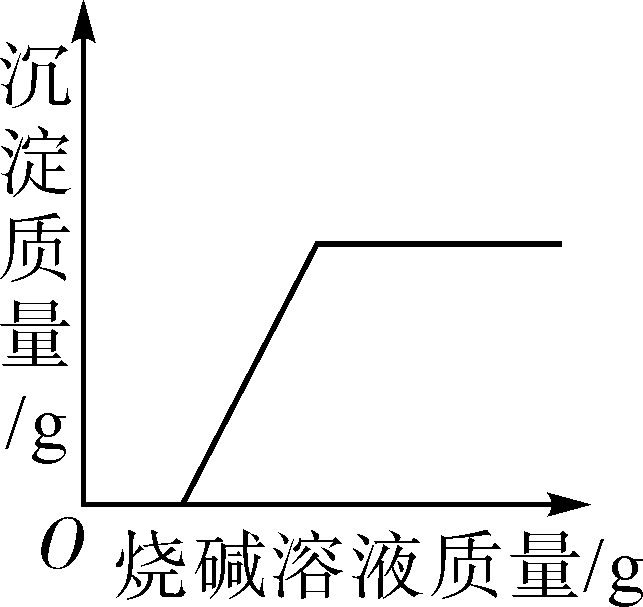 向硫酸和硫酸铜的混合溶液中逐滴加入烧碱溶液至过量
向硫酸和硫酸铜的混合溶液中逐滴加入烧碱溶液至过量


 和
和 的化学计量系数之比为1:1
的化学计量系数之比为1:1