19.为验证质量守恒定律,某学习小组做了镇条在空气中燃烧的实验(图1)。
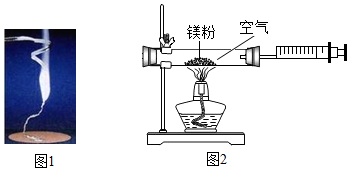
(1)请写出镁条燃烧的化学方程式
。
(2)镁条完全燃烧后,称量发现石棉网上的燃烧产物的质量反而比反应前镁条的质量小,其主导原因可能有
。
A.燃烧增加了氧元素的质量
B.有部分白烟逸散在空气中
C.部分产物粘在坩埚钳上
故探究化学反应前后物质的总质量关系时,如反应过程中有气体参加或生成,需要在
容器中进行。
(3)小红按图2装置改进实验,验证了质量守恒定律,最终得出结论是:参加化学反应的各物质的质量总和
(填“<”、“>”或“=”)反应后生成的各物质的质量总和。
(微观解释)从微观角度分析,在化学反应前后一定不变的是
(选填序号)。
①原子种类
②分子种类
③原子数目
④分子质量
⑤分子数目
⑥原子质量
(4)小红结束图2实验后发现产物中还有一些黄色固体。
【查阅资料】①氧化镁为白色固体;②镁能与氮气反应生成黄色的氮化镁(Mg
3N
2)固体;③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
【提出问题】黄色固体是什么呢?
【做出猜想】黄色固体为Mg
3N
2【实验探究】
| 实验操作 | 实验现象及结论 |
如图,取燃烧产物中的黄色固体于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B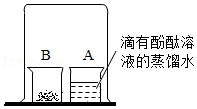 | 现象: 结论:燃烧产物中含Mg3N2 |
【反思与交流】
①空气中N
2的含量远大于O
2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg
3N
2,请给出合理的解释
。
②如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,结合注射器的刻度显示,最终测得氧气体积分数
(填“大于”、“小于”或“等于”)。注射器在本实验中还具备的优点为:
。




 过滤
过滤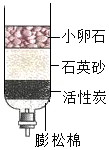 利用简易净水器净化水
利用简易净水器净化水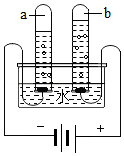 电解水
电解水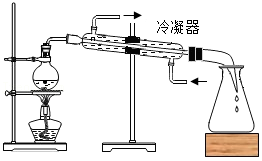 水的蒸馏
水的蒸馏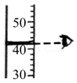 读取液体体积
读取液体体积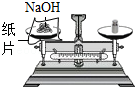 称量NaOH固体
称量NaOH固体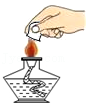 熄灭酒精灯
熄灭酒精灯 检查装置的气密性
检查装置的气密性
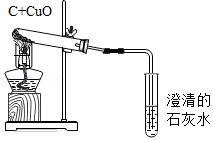
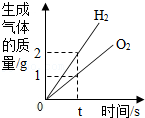 将水通电电解一段时间
将水通电电解一段时间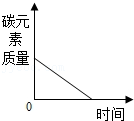 碳在含有氧气的密闭容器中燃烧,容器中碳元素的质量变化
碳在含有氧气的密闭容器中燃烧,容器中碳元素的质量变化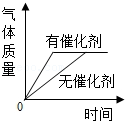 用两份相同的过氧化氢溶液分别制取氧气,生成气体质量的变化
用两份相同的过氧化氢溶液分别制取氧气,生成气体质量的变化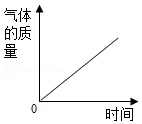 加热一定量的高锰酸钾,生成的氧气质量的变化
加热一定量的高锰酸钾,生成的氧气质量的变化

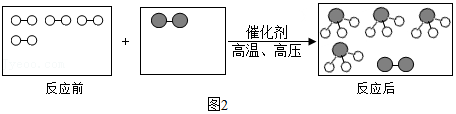
 代表碳原子,〇代表氢原子,
代表碳原子,〇代表氢原子, 代表氧原子。
代表氧原子。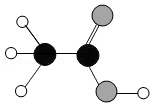


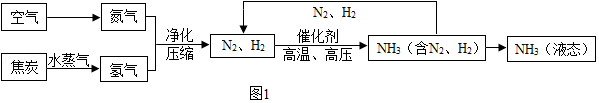
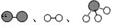 ”分别表示N2、H2、NH3,观察下列微观图:
”分别表示N2、H2、NH3,观察下列微观图: