21.化学实验离不开实验装置的改进和实验探究。
(1)根据以下实验回答问题:
| 实验一:验证分子的性质 | 实验二:硫在氧气中燃烧 | 实验三:一氧化碳还原氧化铜 |
 |  | 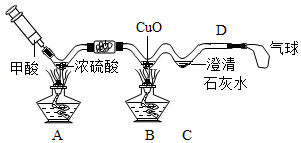 |
资料:甲酸(HCOOH)在热的浓硫酸中分解,生成CO和H
2O(夹持仪器省略)。
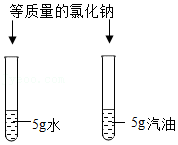
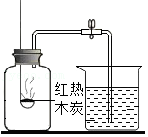
实验一:观察到湿润的蓝色石蕊试纸变红,说明分子具有的性质是
。
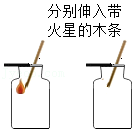
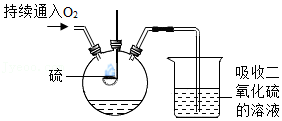
实验二:硫在氧气中燃烧时,产生明亮的
色火焰;该实验装置的优点是
(写出一点即可)。
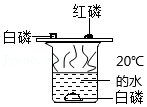
实验三:B处观察到的现象是
;C处反应的化学方程式为
;为了排尽空气防止爆炸,应先点燃
(选填“A”或“B”)处的酒精灯。
(2)兴趣小组对镁带变黑后的物质(主要成分是碱式碳酸镁)进行了探究。
【查阅资料】
Ⅰ.碱式碳酸镁的化学式可表示为Mg
a(OH)
b(CO
3)
c,该物质加热后生成MgO、H
2O、CO
2三种氧化物。
Ⅱ.氢氧化钠溶液能吸收二氧化碳,生成碳酸钠和水。
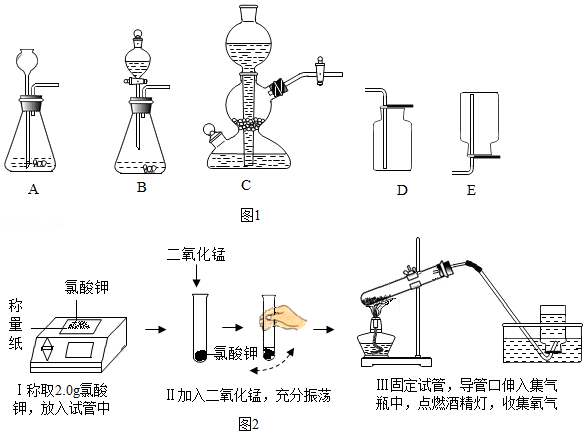
【实验步骤和数据】为确定碱式碳酸镁的化学式,按如图所示装置进行实验。

步骤一:夹住弹簧夹,微热A处玻璃管;
步骤二:点燃酒精灯,至固体完全分解;
步骤三:熄灭酒精灯,通入氮气至冷却。
称量B、C两处,所得数据如表:(A处产生的水蒸气和二氧化碳全部被吸收)
| | 反应前质量 | 反应后质量 |
| B:干燥管和固体 | 51.10g | 51.28g |
| C:广口瓶和液体 | 82.00g | 83.32g |
【解释与结论】
Ⅰ.证明整套装置不漏气的现象是
;
Ⅱ.B处反应的化学方程式为
;
Ⅲ.通过上述数据计算可得:该碱式碳酸镁Mg
a(OH)
b(CO
3)
c中a:b:c=
。(忽略空气中成分及其它因素的影响)




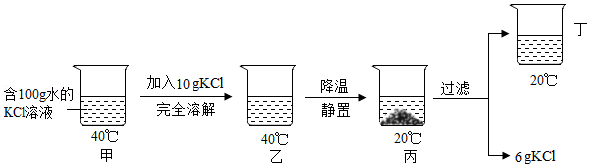
 溶解
溶解 过滤
过滤 蒸发
蒸发 测pH
测pH