21.(1)三星堆考古再次成为考古界的热点。此次考古出土了大量的青铜器、象牙等文物。青铜是铜、锡、铅组成的合金。青铜器中的铜在氯离子等作用下,生成活性很强的氯化亚铜(CuCl)。氯化亚铜易与氧气、水反应生成氯化氢和碱式氯化铜[化学式为Cu
2(OH)
3Cl],其反应的化学方程式为
。去除文物表面的Cl
﹣是保护青铜器文物的重要手段。
同学们发现生活中铜制品长期露置在潮湿空气中也会锈蚀,生成“铜绿”[化学式为Cu
2(OH)
2CO
3]。为探究生活中某铜样品的锈蚀程度(即该铜样品中单质铜的质量分数),并回收铜。
查间资料:①Cu
2(OH)
2CO
3+2H
2SO
4═2CuSO
4+CO
2↑+3H
2O
②Cu
2O+H
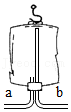
2SO
4═CuSO
4+Cu+H
2O
实验设计:取铜样品(假设除铜和铜绿外,不含其它物质),设计甲、乙两方案。
方案甲:
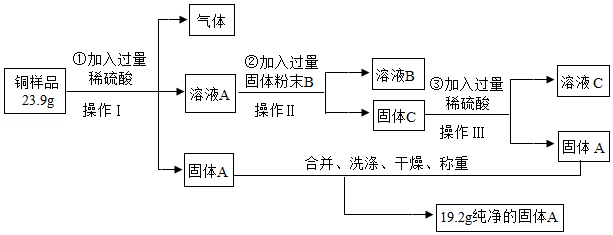
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是
,该操作中都要用到玻璃棒,其作用是
。
(3)若溶液B为浅绿色,任写一个步骤②中发生反应的化学方程式
。
(4)溶液C中的金属离子
(填离子符号)。
方案乙:
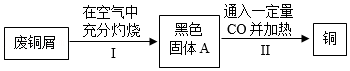
(5)步骤Ⅰ中铜绿受热分解生成黑色固体A、CO
2和H
2O,还发生另一个化合反应也生成黑色固体A,黑色固体A的化学式为
。
(6)步骤Ⅱ所得铜中往往含有少量的Cu
2O。检验铜中含有Cu
2O的实验方法为
(填实验步骤,实验现象)。
数据处理:
(7)①根据方案甲中数据可知,铜样品中单质铜的质量分数为
(小数点保留到0.1%)。
②利用方案乙还原16.0g黑色固体A,得到Cu和Cu
2O的混合物共ag。则a的取值范围为
<a<14.4g。
反思评价:
(8)方案乙的主要缺点为
(任写一条)。



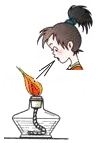 熄灭酒精灯
熄灭酒精灯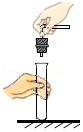 塞紧橡胶塞
塞紧橡胶塞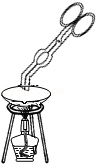 移走加热后的蒸发皿
移走加热后的蒸发皿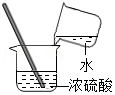 稀释浓硫酸
稀释浓硫酸