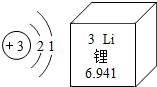
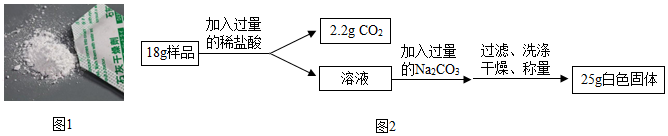
19.盐城是我国唯一以“盐”命名的城市,有着深厚的海盐文化底蕴。食盐是生活必需品,也是重要的化工原料。
Ⅰ.制备
(1)通过晾晒海水,蒸发除去水分,食盐晶体就会逐渐从海水中析出,得到粗盐。析出晶体后的母液是NaCl的
(选填“饱和”或“不饱和”)溶液。
Ⅱ.提纯
(2)实验室中除去粗盐中难溶性杂质获得精盐的步骤是:(称量)溶解→
→蒸发→(称量)计算产率。蒸发操作中玻璃棒的作用是
。实验结束后,计算所得精盐的产率偏低,原因可能是
(填字母序号,下同)。
A.实验所得精盐较潮湿
B.粗盐未充分溶解就过滤
C.过滤时液面高于滤纸边缘
D.实验过程中有部分氯化钠溶液溅出
(三)为除去(2)所得精盐中含有的MgCl
2、CaCl
2两种可溶性杂质,同学们设计了如图流程。
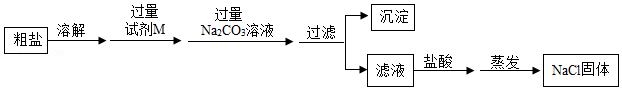
(3)已知试剂M是碱溶液,则M可以是
。
A.NaOH溶液
B.Ba(OH)
2溶液
C.KOH溶液
D.Ca(OH)
2溶液
(4)有同学根据“将溶液蒸发得到NaCl固体”判断:加入盐酸后,溶液的pH一定为7,你认为该判断
(选填“正确”或“错误”)。
Ⅲ.应用
(5)医疗上常使用0.9%的生理盐水,现欲配制500g 0.9%的生理盐水,需要NaCl的质量为
。
(6)工业上用电解饱和食盐水的方法生产烧碱(NaOH),反应原理为:2NaCl+2H
2O
2NaOH+Cl
2↑+X↑。X是一种单质,其化学式为
,依据质量守恒定律作出该推断的理由是
。
(7)应用上述方法生产得到的烧碱中常含有一定量的杂质NaCl。为测定该烧碱的纯度,称取10g样品溶解于适量水中,慢慢加入溶质质量分数为10%的稀盐酸至恰好完全反应,共用去稀盐酸73g。计算10g烧碱样品中NaOH的质量分数(写出计算过程)。




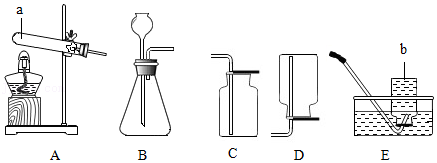
 加热液体
加热液体 量取液体
量取液体 连接仪器
连接仪器 称量固体
称量固体