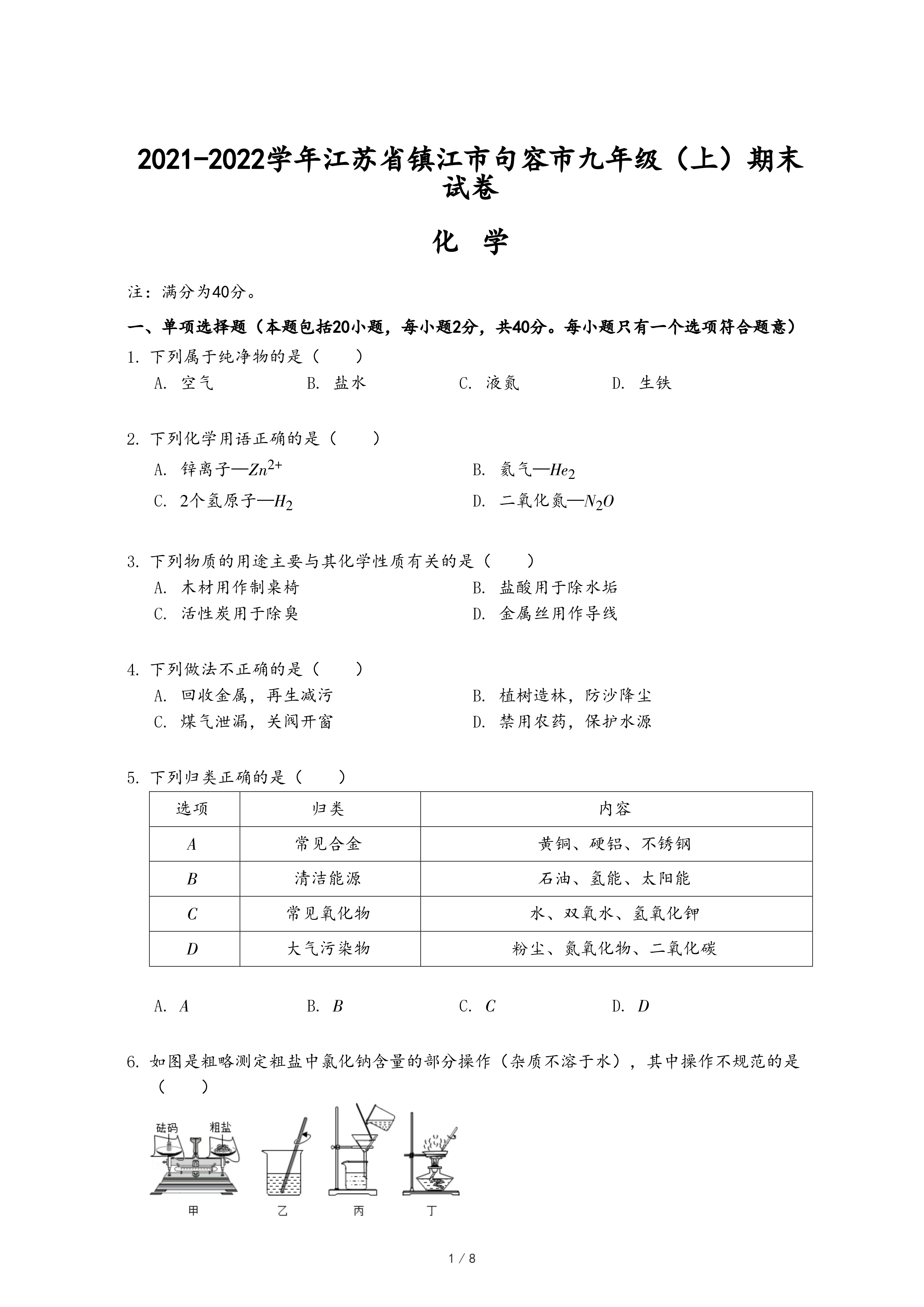
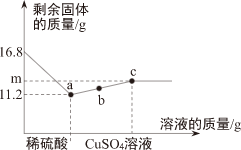
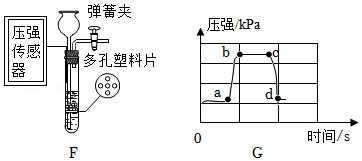
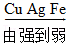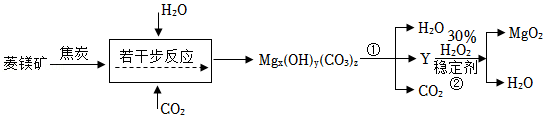29.(一)认识镁的性质
(1)海水中含有大量的钠元素与镁元素,这两种元素最本质的区别是
不同(填“质子数”、“中子数”或“电子数”)。
(2)在化学反应中,镁原子易失去2个电子,形成镁离子的化学符号
。
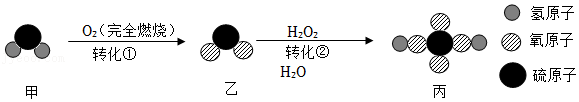
(3)烟花、照明弹中都用到镁粉作原料,原因是镁粉燃烧时
,写出反应的化学方程式
。
(二)制备过氧化镁
过氧化镁(MgO
2)是一种重要的化工原料,医学上可治疗消化不良、胃胀等症状。工业常以菱镁矿(MgCO
3) 为原料来制备,生产工艺部分流程如图所示:
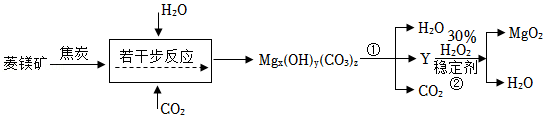
(4)反应时将菱镁矿石粉碎的目的
。
(5)生产流程中,Mg
x(OH)
y(CO
3)
z性质与碱式碳酸铜相似,受热会生成三种氧化物,则物质Y的化学式
。
(6)过氧化镁(MgO
2)中氧元素的化合价为
价,反应②中加入稳定剂来防止H
2O
2分解,写出反应②的化学方程式
。
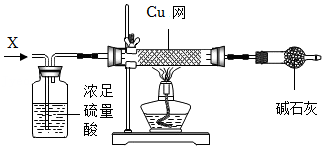
(三)碱式碳酸镁定量测定
碱式碳酸镁Mg
x(OH)
y(CO
3)
z是一种白色固体,举重运动员常将其粉末抹在手上以增大摩擦力。为确定固体的组成,进行如下实验(假设每一步都吸收完全):
[资料]浓硫酸吸收水蒸气
[实验]
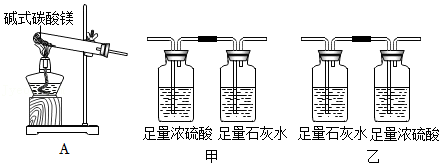
(7)实验前需进行的操作:连接好装置,首先要
。
(8)称取一定质量固体样品于A装置中,将生成的气体缓缓通过上图的
(选填“甲”或“乙”)装置,持续加热至完全分解,最终得到MgO质量为30.0g,足量浓硫酸和足量石灰水装置最终分别增重2.7g、26.4g。
(9)足量石灰水的作用是
,写出该反应的化学方程式
。
(10)已知化学反应前后元素的种类和质量不变,计算出固体样品中镁元素的质量为
g,碱式碳酸镁的化学式为
。