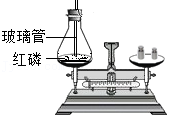
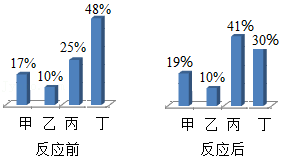
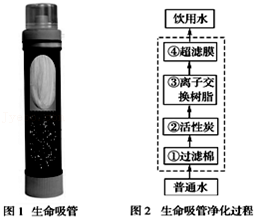
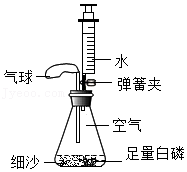
24.某化学兴趣小组选择燃烧镁带进行定量实验探究。
【资料】镁除了与空气中的氧气反应外,还可与空气中的氮气在点燃条件下生成固体氮化镁Mg
3N
2,化学方程式为:3Mg+N
2Mg
3N
2;
第一小组同学称量了0.24g镁带,在空气中点燃,完全燃烧后,称量所得固体质量为0.32g。第二小组同学觉得第一小组的实验数据不合理,分析原因并设计了如图所示的实验,实验步骤如下:
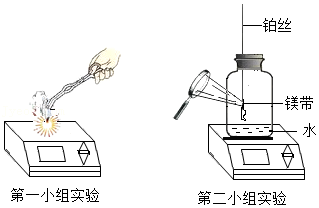
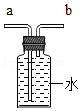
步骤一、将0.24g打磨光亮的镁带固定在穿过瓶塞的铂丝上(铂丝不反应),广口瓶盛满氧气并塞紧瓶塞(如图),瓶底留有适量水;
步骤二、用聚光镜引燃镁带,待其完全燃烧后,充分振荡瓶内的水再静置,瓶内白烟完全消失,有白色固体沉淀在瓶底;(此条件下氧化镁难溶于水且不反应)
步骤三、将瓶内的全部固液混合物过滤,干燥滤纸及其上面的滤渣后一起称量,总质量为1.25g。
请回答下列问题:
(1)写出镁带在氧气中燃烧的化学方程式
。
(2)关于两个小组的实验说法正确的是
。
A.第一组实验数据不合理是因为0.32g>0.24g,不遵循质量守恒定律
B.第二组实验中的水既可加速装置冷却,又可通过水帮助收集瓶内的生成物
C.镁带燃烧时白烟飘散的现象说明分子是永不停息作无规则运动的
D.通过第一组实验数据可推测,镁在空气中燃烧一定还生成了氮化镁,另外可能有部分固体生成物未落到电子天平上
E.第二小组同学只需称量镁带燃烧前后封闭的广口瓶体系总质量,即可验证质量守恒定律
(3)第二小组的同学在进行实验时,若未通过打磨去除镁带表面的氧化膜,最后他们称量的滤纸和滤渣总质量会
1.25g(填>、<或=)。
(4)根据第二小组同学实验数据,若要得到与镁反应的氧气的质量,还必须测量,若实验结果与质量守恒相吻合,请推测以上测量值为
g。



 点燃酒精灯
点燃酒精灯 过滤
过滤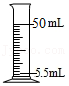 量5.5mL液体
量5.5mL液体 称量10.05g固体
称量10.05g固体 属于化学变化
属于化学变化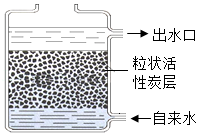 净化后可得纯水
净化后可得纯水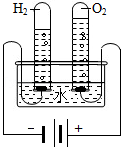 证明水的组成
证明水的组成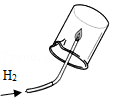 氢气验纯
氢气验纯