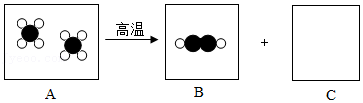
19.我国古代人民积累了许多对物质变化的认识。早在战国时期,《周礼•考工记》中载有“涑帛”的方法,即利用“灰”(草木灰,主要成分为K
2CO
3)和“蜃”(贝壳灰,主要成分为CaO)混合加水所得溶液来洗涤丝帛时,会与丝表面附着的丝胶蛋白发生反应,生成物可用水冲去,从而可把丝洗得干脆亮丽。化学小组对“混合加水所得溶液”的成分进行了探究。
【实验过程】
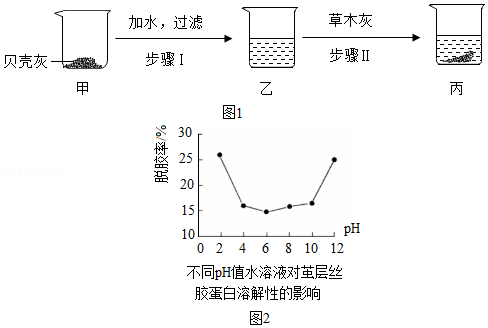
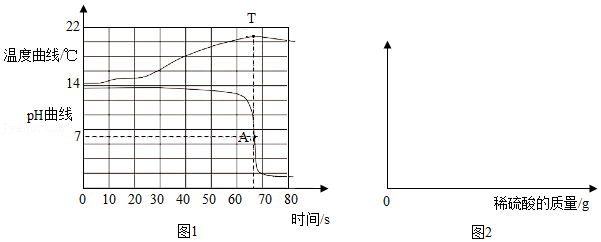
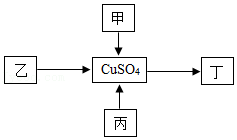
(1)如图1所示,步骤Ⅰ的反应会
(“放出”或“吸收”)热量,步骤Ⅱ的化学方程式为
,属于
反应(填基本反应类型)。
(2)小组同学将烧杯丙中混合物过滤后得到澄清溶液,并对该溶液成分进行探究。
| 实验 | 步骤 | 现象 | 结论 |
| 实验1 | 取少量溶液于试管中,通入CO2。 | ①________ | ②证明该溶液中没有________。 |
| 实验2 | 另取少量溶液于试管中,滴加几滴稀盐酸。 | 始终没有明显现象 | 证明溶液中没有K2CO3。 |
①
;
②证明该溶液中没有
。
【交流谈论】
(3)同学们将实验结果与老师交流,老师认为实验2的结论不一定准确,原因是
。
(4)经过谈论,同学们又进行实验3,请填写表格。
| 实验 | 步骤 | 现象 | 结论 |
| 实验3 | 取少量溶液于试管中,滴加足量的________溶液。(填盐溶液名称) | 有白色沉淀产生 | 证明溶液中有K2CO3。 |
取少量溶液于试管中,滴加足量的
溶液。(填盐溶液名称)
(5)【实验结论】根据以上实验,可得出烧杯丙中澄清溶液含有的溶质是
(填化学式)。
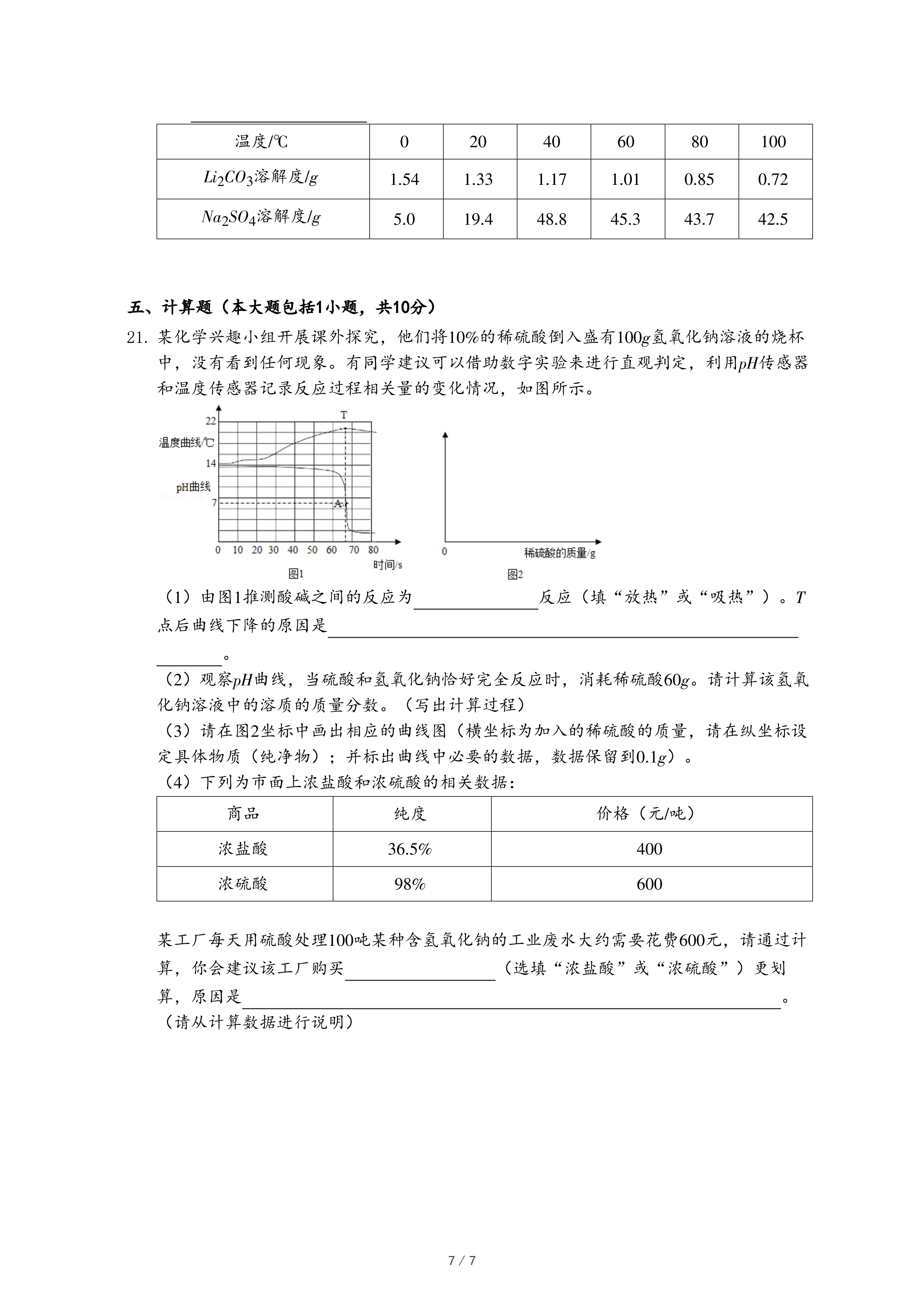
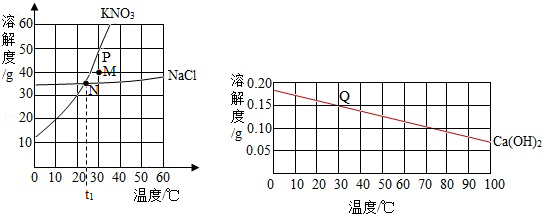
(6)【延伸应用】同学们查阅资料得知,浓度为10%的K
2CO
3的pH=11.6,浓度为1% KOH的pH=13.2,根据图2数据分析,选用
溶液洗涤丝帛效果更好。



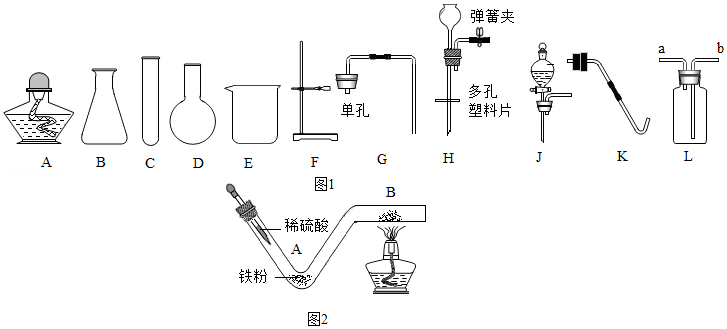
 取用液体药品
取用液体药品 检查装置气密性
检查装置气密性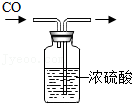 除去CO中的水蒸气
除去CO中的水蒸气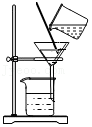 过滤
过滤
 表示碳原子,
表示碳原子, 表示氢原子)
表示氢原子)