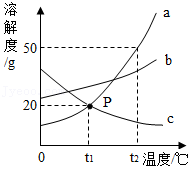
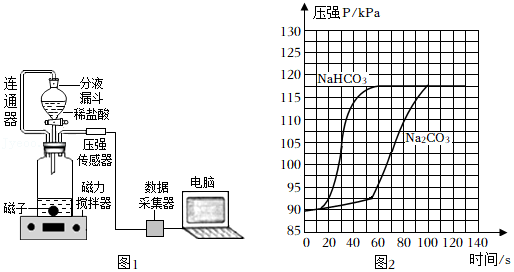
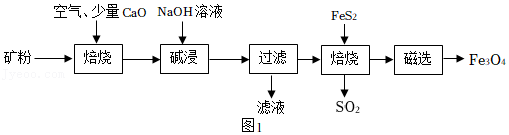
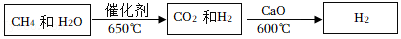25.能源既是国家经济发展的命脉,也是国家发展战略的重要支柱。
(一)人类目前所消耗的能量主要来自化石燃料。
(1)化石燃料包括
、石油、天然气。
(2)“碳中和”主要是指抵消温室气体的排放量,实现正负抵消,达到相对“零排放”。下列说法不正确的是
(填序号)。
A.大力植树造林
B.捕集、利用和封存CO
2C.提倡使用一次性餐具
(3)将石油加热炼制,是利用石油中各成分的
不同,将它们分离得到汽油、煤油、柴油等产品。
(4)天然气用途非常广泛,可作为燃料直接使用。天然气在不同设备中燃烧产生的污染物的含量也不尽相同,几种常见设备中天然气燃烧时产生的污染物(kg/Mm
3)如图1所示:
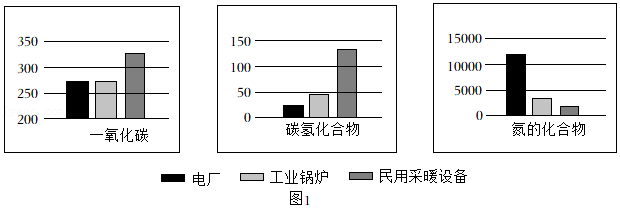
①氮的氧化物排放到空气中可形成酸雨,依据“化学反应前后元素的种类不变”,推测此类酸雨中所含的酸是
(填化学式)。
②在电厂、工业锅炉和民用采暖设备中天然气燃烧效率最低的是
(填字母)。
A.电厂
B.工业锅炉
C.民用采暖设备
(二)氢气被看做是理想的“绿色能源”,氢气的制备和储存是目前的研究热点。
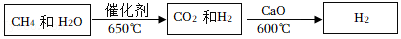
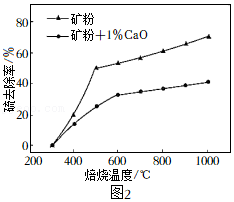
(5)甲烷水蒸气催化重整是制高纯氢的方法之一,主要流程如下:
①甲烷和水蒸气反应的化学方程式是
。
②用CaO可以将CO
2除去转化为CaCO
3,该反应属于基本反应类型中的
。H
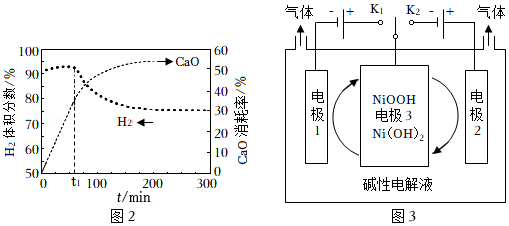
2体积分数和CaO消耗率随时间变化关系如图2所示。从t
1时开始,H
2体积分数显著降低,单位时间CaO消耗率
(填“升高”、“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:
。
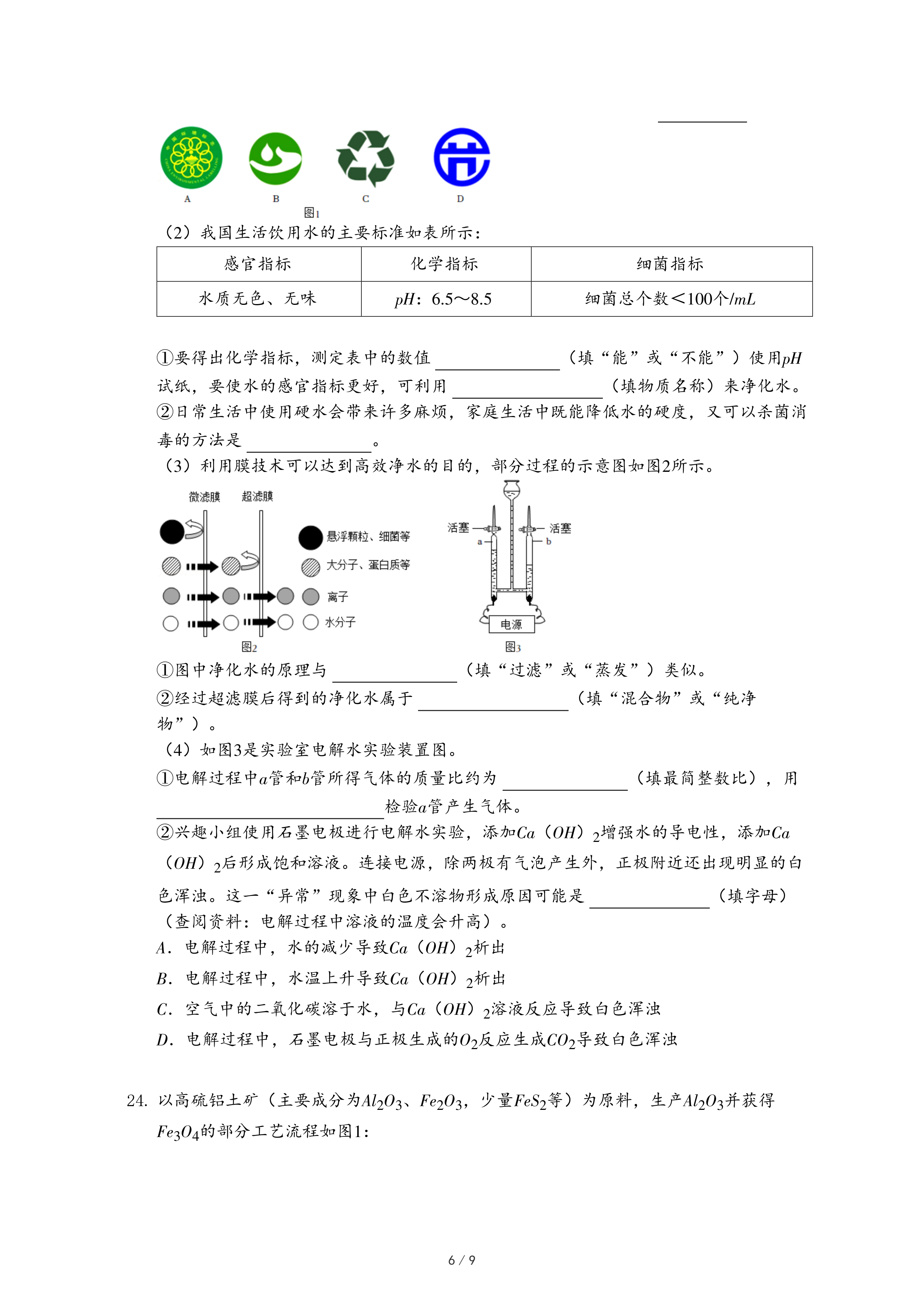
(6)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图3。通过控制开关连接K
1或K
2,可交替得到H
2和O
2。
①制H
2时,连接
(填“K
1”或“K
2”);改变开关连接方式,可得O
2。
②利用太阳能光伏电池电解水制高纯氢的总反应化学方程式为
。
(7)Mg
17Al
12是一种特殊的镁合金。该合金是一种储氢材料,完全吸氢后得到MgH
2和Al,“储氢过程”属于
(填“物理”或“化学”)变化。
(8)开发利用氢能的意义:
(写1点)。



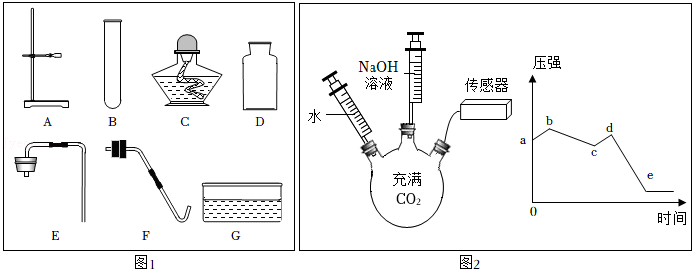
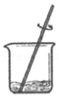 溶解时搅拌,加速溶解
溶解时搅拌,加速溶解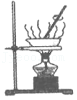 蒸发时搅拌,散热
蒸发时搅拌,散热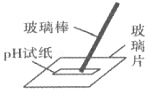 测溶液pH时,蘸取液体
测溶液pH时,蘸取液体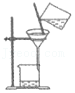 过滤时,引流
过滤时,引流