21.铁及其化合物在生活生产中应用非常广泛。某兴趣小组的同学对于碳酸亚铁的制取和相关性质进行探究。
【查阅资料】
1.溶液pH大于8.8时,Fe
2+可完全转化为Fe(OH)
2沉淀。
2.FeCO
3是白色固体,难溶于水,遇氧气、水会发生反应,生成Fe(OH)
3:遇酸也会发生反应。
3.FeCl
3溶液中滴加KSCN溶液,溶液会变为血红色:而FeCl
2溶液中滴加KSCN溶液,溶液不变色。
【进行实验】
(1)制取FeCO
3。
①兴趣小组的同学将已生锈的铁钉放入稀硫酸中除锈,该反应的化学方程式为
。
②将除尽铁锈后的铁钉再放入足量的稀硫酸中,反应完成后发现溶液中有少量黑色固体出现,说明除锈后的铁钉属于
(填“纯金属”或“合金”)。
③用上述溶液和pH=11.9的Na
2CO
3溶液反应制取FeCO
3时,可能制得FeCO
3的操作是
(填字母)。
A.将少量的FeSO
4溶液与大量的Na
2CO
3溶液同时加入到烧杯中,边加边搅拌
B.先将Na
2CO
3溶液加入烧杯中,再缓慢加入FeSO
4溶液,边加边搅拌
C.先将FeSO
4溶液加入烧杯中,再缓慢加入Na
2CO
3溶液,边加边搅拌
D.先将Na
2CO
3溶液加入烧杯中,再加入过量稀盐酸,最后加FeSO
4溶液,边加边搅拌
(2)探究久置于潮湿空气中FeCO
3的成分。
实验I:
①取少量久置于潮湿空气中的FeCO
3固体于试管中,加入足量的稀盐酸,观察到试管内
,说明该固体中含有FeCO
3。
②取少量上述反应后的溶液于试管中,进行了下一步实验操作,该操作是
,可观察到
,说明久置于空气中的FeCO
3固体中还含有Fe(OH)
3。
实验Ⅱ:
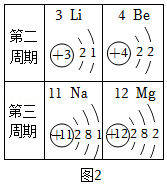
该兴趣小组为进一步确定固体中FeCO
3的质量分数,称取10.0g固体做了如图所示的补充实验。
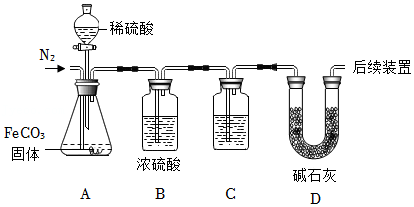
①装置A的分液漏斗中盛放的溶液可以为
(填字母):装置C中盛放的溶液最合适的是
(填字母)。
A.浓盐酸B.稀硫酸C.氢氧化钠溶液D.氢氧化钙溶液
②反应结束后,继续通入一段时间N
2的目的是
。
③实验结束后,测得装置C和D共增重0.44g,则固体中FeCO
3的质量分数为
。
【实验结论】碳酸亚铁在潮湿的空气中易变质,故需要密封保存。



 取用粗盐
取用粗盐 溶解粗盐
溶解粗盐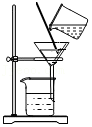 过滤粗盐水
过滤粗盐水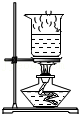 蒸干滤液
蒸干滤液