17.人类文明与社会进步同铁制品的使用关系密切。
(一)铁的广泛应用
1.钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于
,写出成语“百炼成钢”中发生反应的化学方程式
。
2.某品牌的麦片中含微量铁粉,食用后可在胃酸(主要成分是盐酸)的作用下转化为人体可吸收的铁元素,反应的化学方程式为
。
3.高铁酸钾是新型净水剂,化学原理是:4K
2FeO
4+10H
2O=4X+3O
2+8KOH,X的化学式是
。
(二)铁的锈蚀及防护
1.下列情况下铁制品最易生锈的是
(填序号)。
a.潮湿空气中 b.干燥空气中 c.部分浸入食盐水中
2.铁生锈中存在下列转化:Fe(OH)
2Fe(OH)
3,该反应的化学方程式为
。
(三)对含铁样品成分分析
实验课上,老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe
2O
3)粉末中的一种或两种,为确定该粉末的成分,同学们进行了如下探究,请你参与其中并回答问题。
[提出猜想]甲组:铜粉;乙组:氧化铁粉末;丙组:
。
[设计实验]
方案1:取少量红色粉末放入试管中,滴加足量的
(从下列试剂中选择:氯化钠溶液、稀盐酸、氢氧化钠溶液)振荡,若甲组猜想正确,则实验现象为
。
方案2:取10g红色粉末放入硬质玻璃管中,先通入CO,然后用酒精喷灯加热至完全反应,实验装置如图所示),停止加热并继续通入CO至装置冷却。
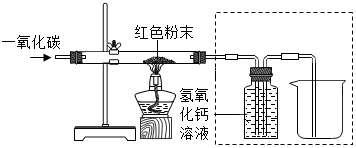
实验过程中将反应后的气体通入虚线框内足量 的氢氧化钙溶液中,其作用有检验并吸收生成CO
2和
等。
[数据处理]若乙组猜想正确,则硬质玻璃管内发生反应的化学方程式是
。实验时要先通CO再加热的目的是
。若丙组猜想正确,等装置完全冷却到室温,重新称量氢氧化钙溶液的总质量增加了6.6g,则该氢氧化钙溶液吸收CO
2生成沉淀质量为
;原红色粉末中氧化铁的质量分数为
。




 等质量,等质量分数的稀盐酸和氢氧化钠溶液混合
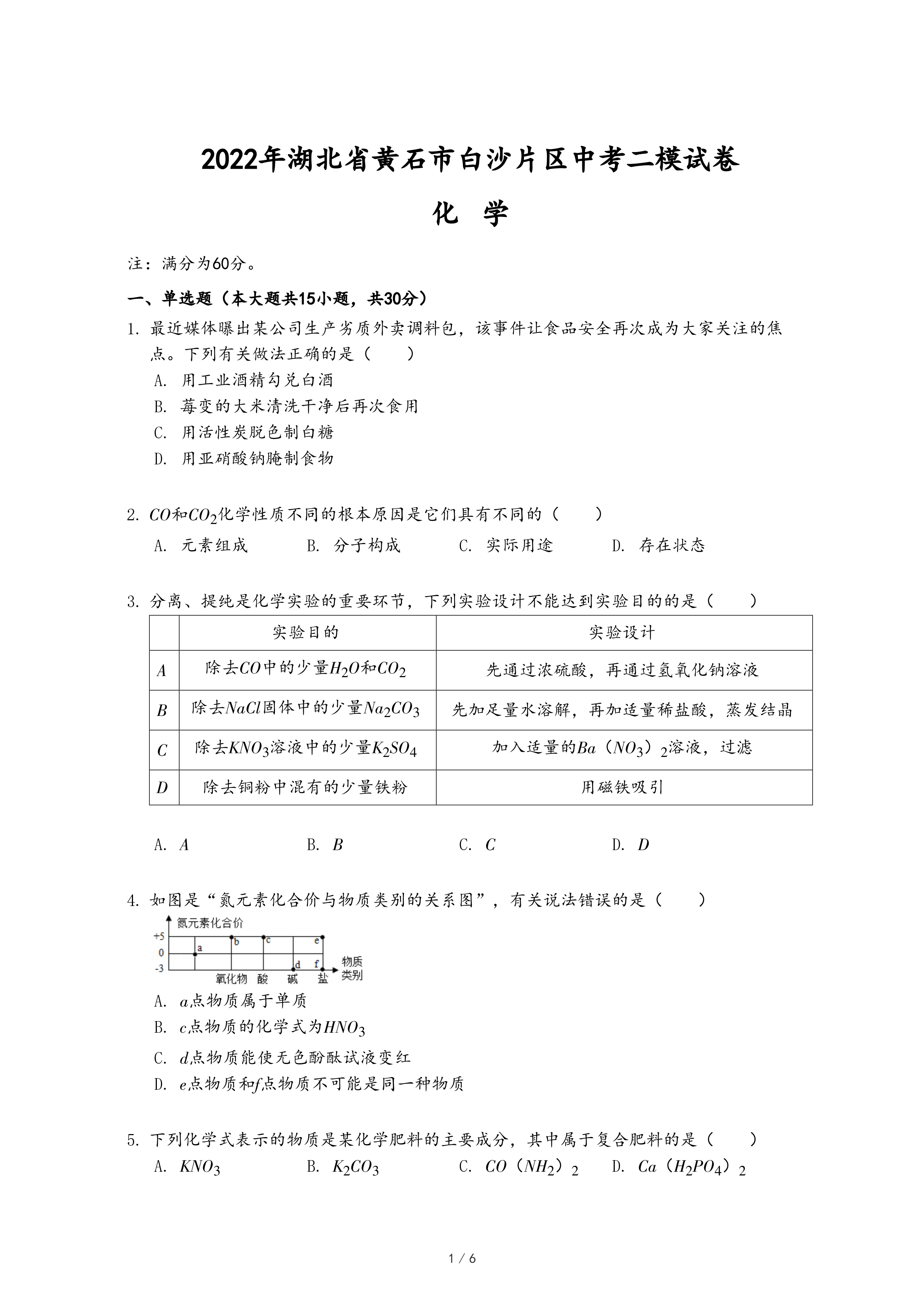
等质量,等质量分数的稀盐酸和氢氧化钠溶液混合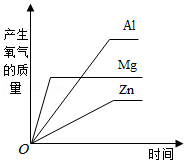 等质量的镁、铝、锌与足量的稀硫酸反应
等质量的镁、铝、锌与足量的稀硫酸反应 将过量的铁粉加入等质量,等质量分数的硝酸银和硝酸铜的混合溶液中
将过量的铁粉加入等质量,等质量分数的硝酸银和硝酸铜的混合溶液中 将氢氧化钡固体加入到一定溶质质量分数的稀硫酸中
将氢氧化钡固体加入到一定溶质质量分数的稀硫酸中 铁狮子
铁狮子 金缕玉衣
金缕玉衣 翠玉白菜
翠玉白菜 司母戊鼎
司母戊鼎