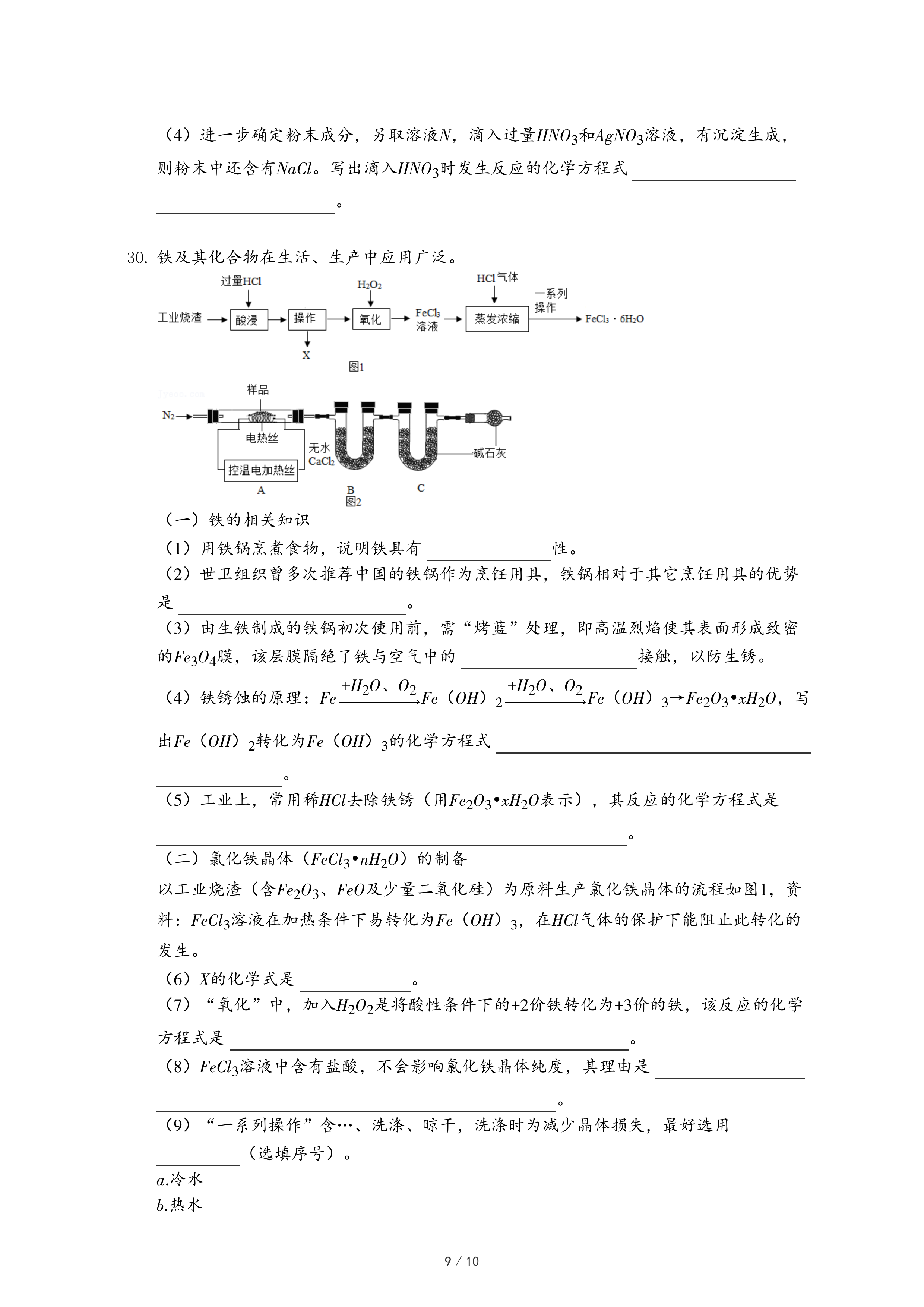
30.铁及其化合物在生活、生产中应用广泛。

(一)铁的相关知识
(1)用铁锅烹煮食物,说明铁具有
性。
(2)世卫组织曾多次推荐中国的铁锅作为烹饪用具,铁锅相对于其它烹饪用具的优势是
。
(3)由生铁制成的铁锅初次使用前,需“烤蓝”处理,即高温烈焰使其表面形成致密的Fe
3O
4膜,该层膜隔绝了铁与空气中的
接触,以防生锈。
(4)铁锈蚀的原理:Fe
Fe(OH)
2Fe(OH)
3→Fe
2O
3•xH
2O,写出Fe(OH)
2转化为Fe(OH)
3的化学方程式
。
(5)工业上,常用稀HCl去除铁锈(用Fe
2O
3•xH
2O表示),其反应的化学方程式是
。
(二)氯化铁晶体(FeCl
3•nH
2O)的制备
以工业烧渣(含Fe
2O
3、FeO及少量二氧化硅)为原料生产氯化铁晶体的流程如图1,资料:FeCl
3溶液在加热条件下易转化为Fe(OH)
3,在HCl气体的保护下能阻止此转化的发生。
(6)X的化学式是
。
(7)“氧化”中,加入H
2O
2是将酸性条件下的+2价铁转化为+3价的铁,该反应的化学方程式是
。
(8)FeCl
3溶液中含有盐酸,不会影响氯化铁晶体纯度,其理由是
。
(9)“一系列操作”含…、洗涤、晾干,洗涤时为减少晶体损失,最好选用
(选填序号)。
a.冷水
b.热水
c.95%的乙醇溶液
(三)氯化铁晶体的热重分析
经科研人员测定,以上得到的是FeCl
3•nH
2O和Fe(OH)
3的混合物。称取该混合物样品64.8g,用如图2装置进行热分解实验。已知:Mr(FeCl
3)=162.5、Mr(Fe(OH)
3)=107
【资料】
①氯化铁晶体在120℃开始分解,生成Fe(OH)
3、H
2O、HCl,200℃分解完全;
②在220℃时,Fe(OH)
3开始分解为Fe
2O
3,500℃时分解完全;
③无水CaCl
2作为干燥剂,不吸收HCl。
(10)装配好实验装置后,要先
。
(11)加热前后均需通入N
2,加热后通N
2的目的是
。
| 温度/℃ | 室温 | 500 |
| B装置/g | 200.0 | 218.9 |
| C装置/g | 200.0 | 221.9 |
(12)加热玻璃管,测得500℃时B、C的质量变化如表,玻璃管内剩余固体的质量为24.0g。
①样品中铁元素的质量为
g。
②n=
。
(13)实验结束,不改变原有装置,将N
2改为通入CO,对24.0g剩余固体继续加热一段时间,冷却,得到黑色粉末20.0g,该黑色粉末的成分是
。



 装药品
装药品 制取CO2
制取CO2 除去HCl
除去HCl 收集CO2
收集CO2











