30.铁及其化合物在生产生活有广泛的应用。、
一、铁的相关知识
(1)磁铁矿是早期司南(如图)的材料,磁铁矿中所含铁的氧化物主要是
。
(2)西汉有“曾青得铁化为铜”之说,用化学方程式表示其原理
。
(3)某钢中含有少量Mn;MnO
2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为
。
(4)铁锈主要成分是Fe
2O
3•nH
2O,铁生锈主要与空气中的
有关。
二、废铁屑的利用
草酸铁钾晶体[K
3Fe(C
2O
4)
3•xH
2O]是一种光敏材料。用废铁屑(主要成分为Fe,含少量Fe
2O
3)制备该晶体主要流程如下:
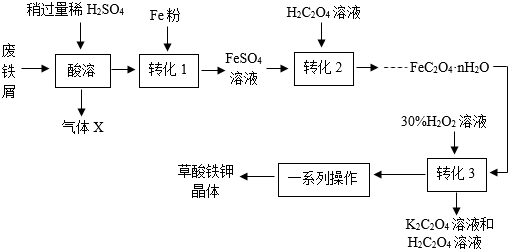
(5)“酸溶”时,产生的气体X为
。
(6)“转化1”中加入铁粉是将+3价的铁转化为+2价的铁,该反应的化学方程式为
。
(7)“转化2”反应生成FeC
2O
4•nH
2O的化学方程式是
。
(8)“转化3”需控制一定的温度,但温度不能太高的原因是
。
三、草酸铁钾晶体的实验
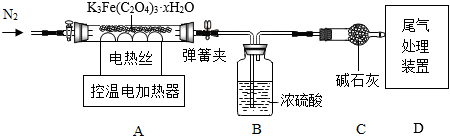
称取9.82g草酸铁钾晶体,用如图装置进行热分解实验。
【资料】①Mr[K
3Fe(C
2O
4)
3]=437
②草酸铁钾晶体在110℃时失去全部结晶水,230℃时完全分解生成K
2CO
3、Fe、FeO、CO、CO
2。
(9)连接好装置后,要先
。
(10)控制温度对A中固体加热,加热前后及过程中均需通入N
2。当加热到110℃后,通入N
2的目的是防止倒吸和
。
(11)数据处理:测得B、C装置在不同温度下的质量,如下表所示。230℃反应结束后,A中剩余固体5.42g。
| 温度/℃ | 室温 | 110 | 230 |
| B装置/g | 200.00 | 201.08 | 201.08 |
| C装置/g | 200.00 | 200.00 | 202.20 |
计算:①x=
。
②5.42g剩余固体中单质Fe的质量为
g。
③上述K
3Fe(C
2O
4)
3热分解的化学方程式
。





 称量
称量 量取
量取 溶解
溶解 测pH
测pH