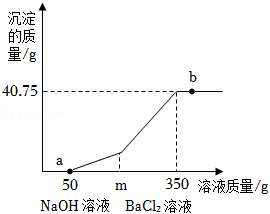
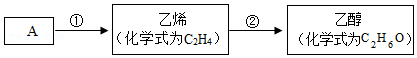
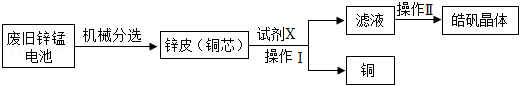
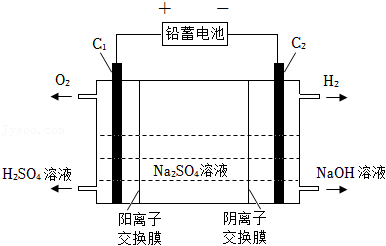
30.铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用
(1)如图1,市售“加铁酱油”中的铁是指
。(选填序号)
A.铁单质
B.铁原子
C.铁元素
(2)加铁酱油的包装中不含有的材料是
。(选填序号)
A.合成材料
B.无机非金属材料
C.金属材料
(3)某面粉中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁,反应的化学方程式为
。已知在酱油中添加了乙二胺四乙酸铁钠(化学式为C
10H
12FeN
2NaO
8•xH
2O,C
10H
12FeN
2NaO
8的相对分子质量是367),铁锈味弱、铁吸收率高,是适宜于酱油中食用的理想补铁剂,它属于
(填无机物或有机物),已知在乙二胺四乙酸铁钠中铁的质量分数约为13.3%,则X≈
(保留到整数)。
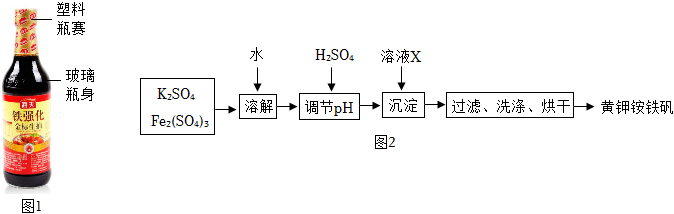
(二)黄钾铵铁矾的制取
黄钾铵铁矾[KNH
4Fex(SO
4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如图2:
(4)在实验室中可以用铁红(Fe
2O
3)来制取Fe
2(SO
4)
3,发生反应的化学方程式为
。
(5)溶液X是
。(选填序号)
A.烧碱溶液
B.石灰水
C.氨水
(6)加入溶液X后反应时温度不宜过高的原因是
。
(7)检验黄钾铵铁矾已洗净的方法是
。
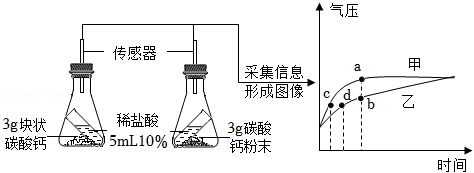
(三)黄钾铵铁矾组成确定
称取9.81g黄钾铵铁矾,用如图3装置进行热分解实验。
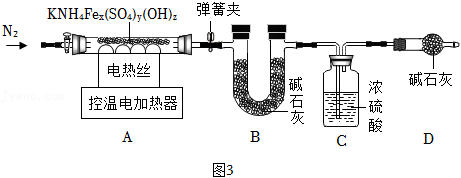
【资料】KNH
4Fex(SO
4)y(OH)z在300℃分解生成NH
3、SO
3和水蒸气(NH
3与SO
3分子数之比为2:1),此时A中剩余固体为KFe(SO
4)
2、Fe
2O
3、Fe
2(SO
4)
3;提高温度至550℃继续分解产生SO
3,并得到Fe
2O
3和K
2SO
4。
(8)装配好实验装置后,先要
。
(9)分别控制温度在300℃、550℃对A中固体加热。
①控制温度在300℃加热,实验后测得B装置质量增加1.57g,C装置质量增加0.17g。
②控制温度在550℃,加热至反应完全,B装置质量又增加2.4g。
300℃时,需缓缓通入N
2,其目的是
。
(10)反应完全后,将A装置中固体溶于足量水,过滤,洗涤,烘干,得固体和滤液,将滤液蒸干得0.87g固体(不含结晶水),则550℃时完全反应后A中剩余固体的质量是
g。
(11)黄钾铵铁矾的化学式是
,300℃时黄钾铵铁矾发生反应的化学方程式为
。




 取用粗盐
取用粗盐 溶解粗盐
溶解粗盐 过滤粗盐水
过滤粗盐水 蒸干滤液
蒸干滤液