



| 选项 | 归类 | 内容 |
| A | 常见溶液 | 食醋、液氮、蔗糖水 |
| B | 清洁能源 | 风能、氢能、太阳能 |
| C | 营养物质 | 淀粉、油脂、蛋白质 |
| D | 常见的碱 | 氨水、火碱、熟石灰 |
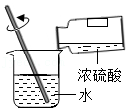 稀释浓硫酸
稀释浓硫酸 加入锌粒
加入锌粒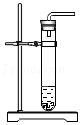 产生氢气
产生氢气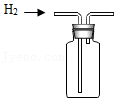 收集氢气
收集氢气由多到少 |
| O2、N2、CO2 |
由大到小 |
| 柠檬汁、蒸馏水、肥皂水 |
由高到低 |
| NaClO、Cl2、NaCl |
由大到小 |
| NO、N2O5、NO2 |
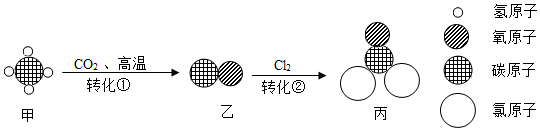
| 点燃 |
| 通电 |
点燃 |
| O2 |
H2O |
高温 |
| CO |
稀盐酸 |
酶 |
| O2 |
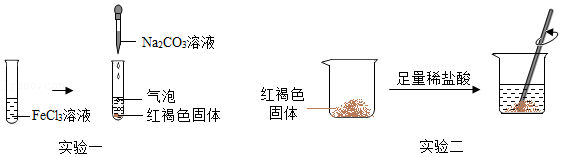
CaCl2溶液 |
Na2CO3溶液 |
稀HCl |
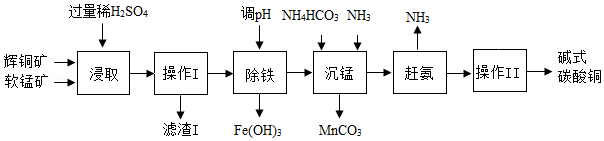
| 选项 | 物质 | 目的 | 主要实验操作 |
| A | 蚕丝和羊毛 | 鉴别 | 取样,分别灼烧,闻气味 |
| B | CaO(CaCO3) | 除杂 | 向固体中加入适量稀盐酸 |
| C | N2(O2)气体 | 检验 | 伸入带火星的木条,观察是否复燃 |
| D | BaCO3和BaSO4 | 分离 | 先加入过量稀盐酸过滤、洗涤、干燥,向所得滤液中加过量Na2CO3溶液,过滤、洗涤、干燥 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
| Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
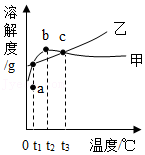
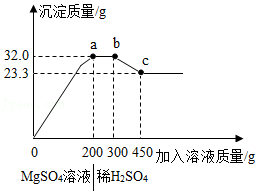
| △ |
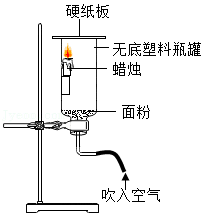

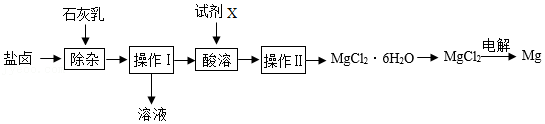
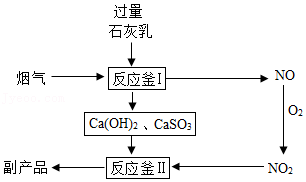
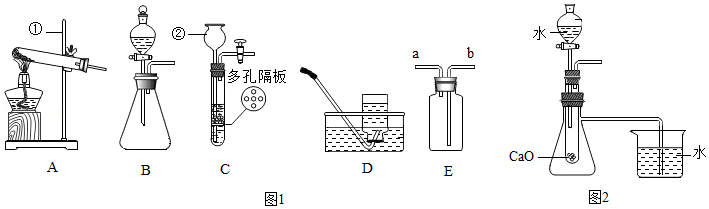

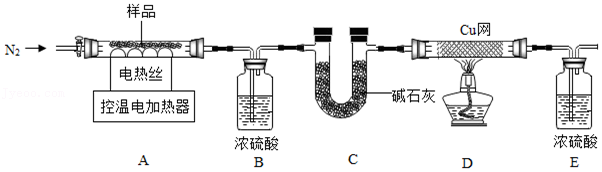
| 温度/℃ | 装置A | 装置B | 装置C | 装置D |
| 实验前/g | 234.6 | 200.0 | 200.0 | 100.0 |
| 实验后/g | 222.4 | 201.8 | 208.8 | x |