19.加热碳酸氢铵时闻到了刺激性气味,引起了同学们对氨气的兴趣,决定对其进行探究。
(一)探究性质与变化
【实验方案】如图所示

【实验现象】
(1)实验一中的现象是
。
(2)实验二中先滴入浓氨水,一段时间后,再滴入浓盐酸。滴入浓盐酸后观察到的现象是:①集气瓶中从下至上出现白烟,②
(写一点)。
【实验结论】
(3)微观上,说明微粒具有的性质是
。宏观上,从物质的性质或变化的角度分析,你得出的结论是
(写一点)。
【反思与评价】
(4)实验二避免了实验一的不足,改进后的优点有
(写一点)。
(二)验证氨气中氮、氢两种元素的质量比
【查阅资料】
(5)氨气在加热条件下能与氧化铜反应:2NH
3+3CuO
3X+N
2+3H
2O,X的化学式是
。
【设计方案】如图所示:(假定氮气被完全吸收)
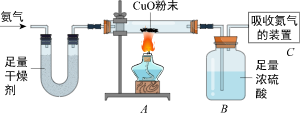
【数据处理与误差分析】
充分反应后,测得A、B、C三个装置在反应前后的质量变化如下表所示:
| 装置 | A | B | C |
| 数据 | 减少了4.8g | 增加了6.0g | 增加了2.8g |
(6)甲同学利用A、B、C三组装置所提供的数据,乙同学利用B、C两组装置所提供的数据,计算出的氮、氢元素的质量比都与理论值明显不符,分析产生误差的原因是
。
(7)若用A、C两组装置所提供的数据计算,与理论值是否相符?写出简单的计算过程证明你的结论
。
(三)探究用途与制法
(8)在一定条件下,可用氮气和氢气制得氨气。工业上常用氨气生产氮肥(NH
4)
2SO
4,施肥时,要避免与之混用的是
(填序号)。
A.硝酸钾 B.草木灰(主要成分是K
2CO
3) C.熟石灰 D.氯化钾
(9)工业上生产的(NH
4)
2SO
4中常常混有少量KCl,检验其是否含有KCl的操作方法是
。
附:部分碱、酸、盐的溶解性表(20℃)
| 阴离子/阳离子 | OH- | NO3- | Cl- | SO42- |
| H+ | | 溶、挥 | 溶、挥 | 溶 |
| K+ | 溶 | 溶 | 溶 | 溶 |
| NH4+ | 溶、挥 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不 |
| Ag+ | ---- | 溶 | 不 | 微 |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“一”表示那种物质不存在或遇到水就分解了。