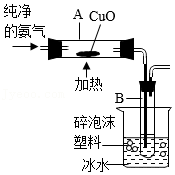
15.铜及其化合物在生产生活中有重要应用。某同学对铜及某些含铜物质进行探究。
[温故如新]
(1)在①CuO②Cu(OH)
2③CuCl
2④Cu
2(OH)
2CO
3[也可表示为CuCO
3•Cu(OH)
2]这4种物质中,属于碱的有
(填序号));除①CuO外,其余3种物质在常温下易溶于水有
(填序号)。
(2)考古出土的春秋末期制造的青铜剑,历经2500余年,其表面且有一层薄锈,但仍寒光逼人,剑刃锋利。由此可知,青铜具有的特性有
(任写一条)。铜器表面的薄锈是铜与空气中的氧气、水、
等物质发生反应所形成。
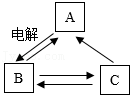
[提出问题]除H
2、CO能还原CuO外,是否还有其他气体能够还原CuO得到金属铜?怎样从含CuCl
2、FeCl
3的某工业废液中回收金属铜和FeCl
2溶液?
[查阅资料]a.通常状况下,氨气极易溶于水形成溶液;加热时,氨气能与CuO反应生成氮气和金属铜等,可用如图所示装置验证。b.在溶液中能发生反应2FeCl
3+Fe═3FeCl
2。
[进行实验1]
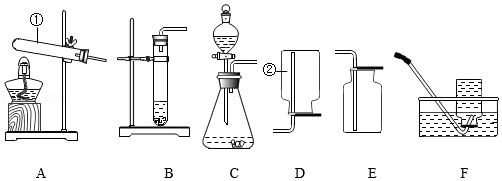
(3)按图示连接装置,检查气密性后,加(通)入相关药品,后续操作均按规范要求进行,完成实验。
①将CuO粉末装入玻璃管A中的具体操作方法是
。
②实验时,在试管B中能够观察到的现象是有液体出现,该液体是
(填“纯净物”或“混合物”)。
③从环保角度看该装置的不足之处是
。
[进行实验2]
(4)取适量含CuCl
2、FeCl
3的某工业废液样品,向其中加入过量铁粉并充分反应后,过滤,将滤渣和足量
(填“稀盐酸”或“稀硫酸”)充分反应,再
(填操作名称)、洗涤、干燥即可回收得到金属铜;所得滤液中含有需要回收的FeCl
2。
[拓展延伸]
(5)已知:加热时,葡萄糖溶液与氢氧化铜悬浊液能发生反应。实验室可用CuSO
4溶液等物质检验葡萄糖的存在,具体实验过程为:在试管中加入2mL 10%NaOH溶液,滴加5% CuSO
4溶液5滴(每滴溶液按0.04mL计算。两种溶液的密度均按1g/mL计算),混合均匀,充分反应,得混合物A。再向上述试管中加入几滴10%葡萄糖溶液,并在酒精灯上加热至沸腾,片刻后生成红色沉淀B,检验完成。则混合物A显
(填“中性”或“碱性”);红色沉淀B是
[填“CuO”或“Cu
2O”“或“Cu(OH)
2”]。