13.化学实验小组的同学在用锌粒与如图1硫酸溶液(试剂瓶标签部分腐蚀)反应时,发现有气泡产生,并闻到有刺激性气味。他们对此气体的成分进行了探究。

【提出问题】锌粒加入该硫酸溶液反应生成的气体是什么?
【查阅资料】
①浓硫酸与锌反应,但不产生氢气,也不会产生氧气,能生成二氧化硫气体;
②二氧化硫有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
(1)【猜想与假设】
甲同学认为:气体可能是H
2;
乙同学认为:气体可能是SO
2;
丙同学认为:气体还可能是
。
【实验探究】
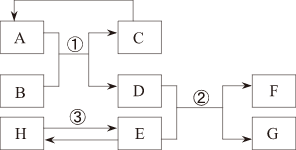
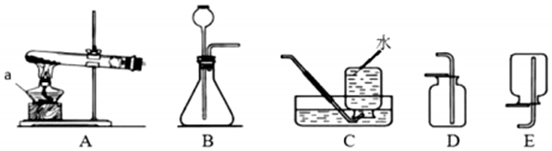
为了验证上述猜想,同学们在老师的指导下设计了如图2的装置(部分夹持器材略去,假设每个能发生的反应都进行完全)进行探究:

(2)图3中D处气体发生装置可选图2中的
(填字母序号)。
(3)实验开始后,观察到E中品红溶液褪色,证明气体中含有
。
(4)H装置的作用是
。写出发生反应的化学方程式
。
(5)F装置的作用是
。
(6)G装置在点燃酒精灯加热之前应先通一段时间的气体。目的是
;加热一段时间后,观察到
,证明气体中含有H
2。
(7)【实验结论】
同学的猜想是正确的。
(8)【反思与交流】
①锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么反应过程中又产生了氢气呢?用文字简述原因:
。
②锌与浓硫酸、稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是
(任填一种合理的答案)。





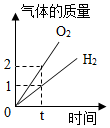 图表示水电解实验中生成氢气与氧气体积比
图表示水电解实验中生成氢气与氧气体积比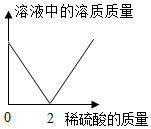 图表示Ba(OH)2溶液中逐渐滴加稀H2SO4后溶液中的溶质质量变化
图表示Ba(OH)2溶液中逐渐滴加稀H2SO4后溶液中的溶质质量变化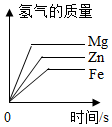 图表示足量的Mg、Fe、Zn与等质量、等质量分数的稀硫酸溶液反应产生氢气的质量
图表示足量的Mg、Fe、Zn与等质量、等质量分数的稀硫酸溶液反应产生氢气的质量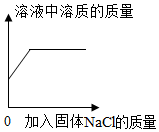 图表示同一温度下饱和NaCl溶液中加入固体NaCl,溶液中溶质的质量变化
图表示同一温度下饱和NaCl溶液中加入固体NaCl,溶液中溶质的质量变化