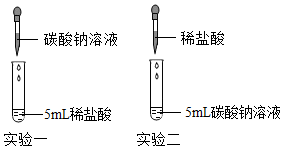
29.某化学兴趣小组在实验室探究碳酸钠溶液与稀盐酸的反应原理,请你一起完成实验探究。
实验一:在5mL稀盐酸中逐滴加入碳酸钠溶液,边滴边振荡,直至滴完5mL碳酸钠溶液。
(1)现象:开始有气泡产生,一段时间后无气泡产生。写出碳酸钠与稀盐酸反应的化学方程式
。在反应后的溶液中加入2滴酚酞溶液,溶液变红,则反应后溶液中的溶质是
。
实验二:在5mL碳酸钠溶液中逐滴加入稀盐酸,边滴边振荡,直至滴完5mL稀盐酸。
现象:整个实验过程无气泡产生。
【提出问题】用量相同的两种反应物,滴加顺序不同,现象为什么不一样呢?
【查阅资料】碳酸钠溶液与盐酸反应:
1.盐酸过量时,反应生成NaCl、CO
2和H
2O;
2.盐酸不足时,产物是NaCl和NaHCO
3。
(2)【假设猜想】实验二结束后,试管中溶液的溶质有哪些?
猜想1:NaCl、Na
2CO
3和NaHCO
3猜想2:
猜想3:NaCl
猜想4:NaCl和HCl
小明认为猜想3和4明显不合理,理由是
。
(3)【实验探究】实验二结束后,将试管中溶液分成三等份,分别做下列三个实验。
| 序号 | 实验操作及实验现象 | 实验结论 |
| 实验1 | 加入硝酸银溶液,产生白色沉淀
再加入稀硝酸溶液,沉淀不消失 | 溶液中含 (写离子符号) |
| 实验2 | 加入 溶液,无沉淀产生 | 猜想1不成立 |
| 实验3 | 加入 溶液,有 产生。 | 猜想2成立 |
【交流反思】用量相同的两种反应物,滴加顺序不同,现象和产物可能都不一样。
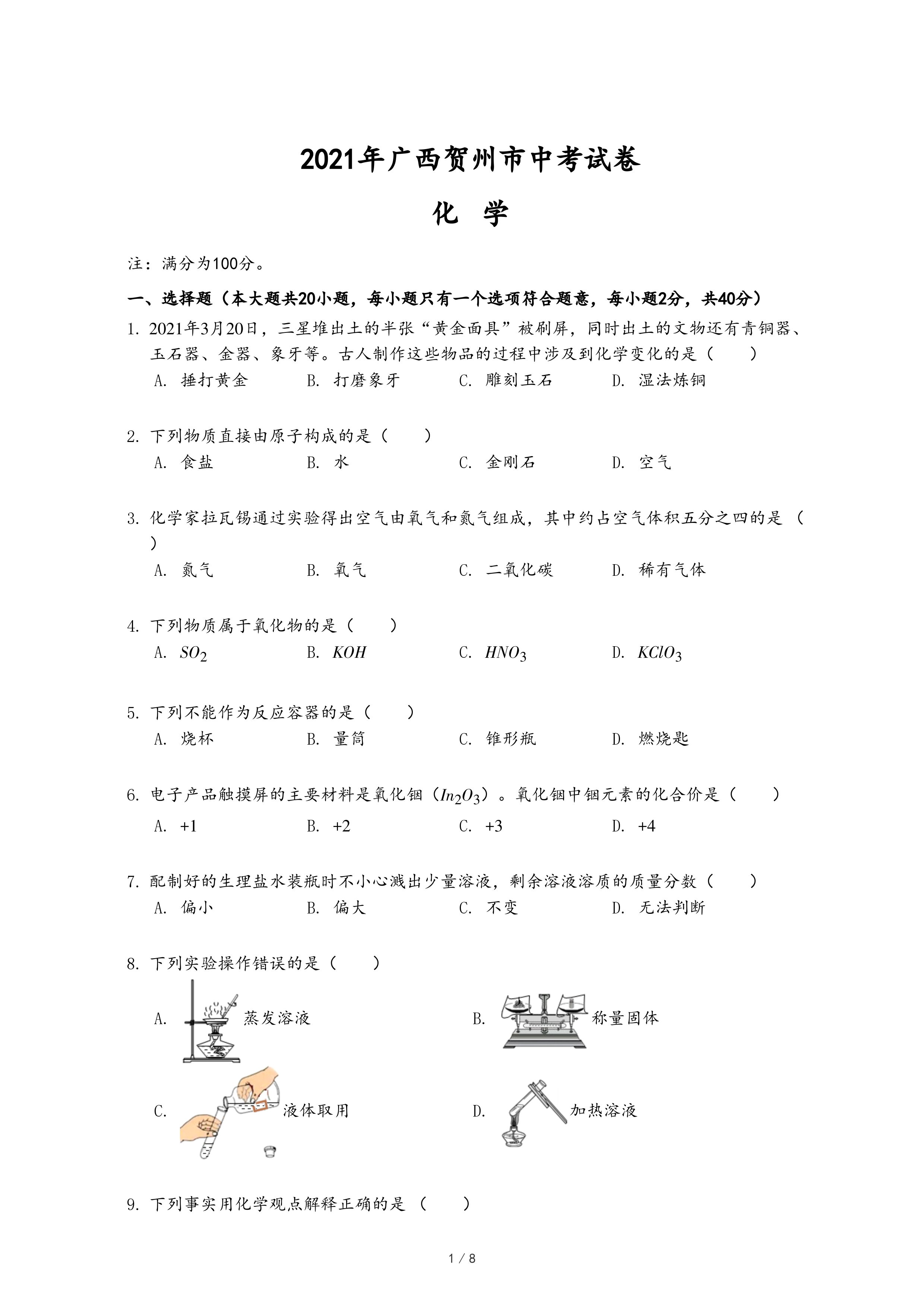



 蒸发溶液
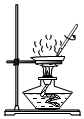
蒸发溶液 称量固体
称量固体 液体取用
液体取用 加热溶液
加热溶液
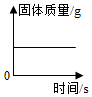 一定量的氧化铜和炭粉在空气中灼烧
一定量的氧化铜和炭粉在空气中灼烧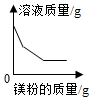 向一定量的氯化亚铁和氯化铜混合溶液中加入过量镁粉
向一定量的氯化亚铁和氯化铜混合溶液中加入过量镁粉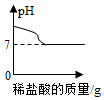 往10g 10%的氢氧化钠溶液中缓慢滴加10g 10%的稀盐酸
往10g 10%的氢氧化钠溶液中缓慢滴加10g 10%的稀盐酸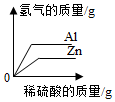 质量相等的铝粉和锌粉分别加入足量的稀硫酸
质量相等的铝粉和锌粉分别加入足量的稀硫酸