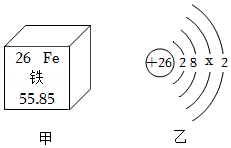
21.铜是人类使用最早、应用广泛的金属材料。某兴趣小组对铜及其化合物的性质进行了探究。
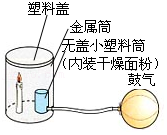
(一)探究长期放置在空气中的铜表面生锈,生成“铜绿”(化学式;Cu
2(OH)
2CO
3)的原因。
【查阅资料】碱石灰能吸收二氧化碳和水蒸气,氢氧化钠溶液能吸收二氧化碳。
【设计实验】
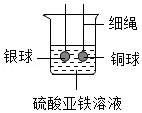
| 序号 | a | b | c | d |
| 实验装置 | 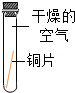 | 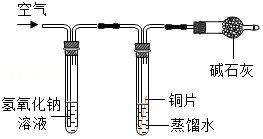 | 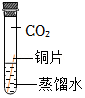 | 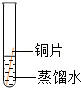 |
| 实验现象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈 |
【得出结论】
(1)说明铜生锈需要水的一组实验是
(填实验序号);
(2)通过实验证明铜与H
2O和
。反应产生“铜绿”。
(3)碱石灰的作用是
。
(二)探究CuO和氢气的反应产物
【查阅资料】氧化亚铜为红色固体,溶于氨水得到蓝色溶液。
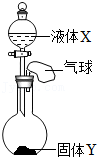
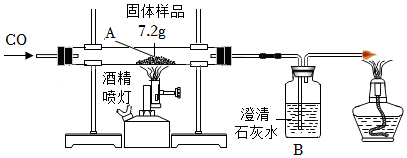
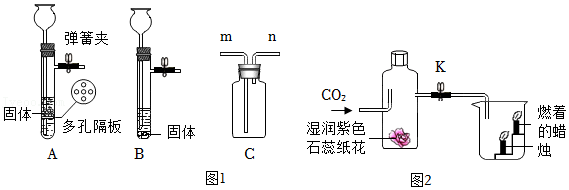
【进行实验】实验①:如图1所示实验装置,进行氢气还原氧化铜实验并检验固体产物。
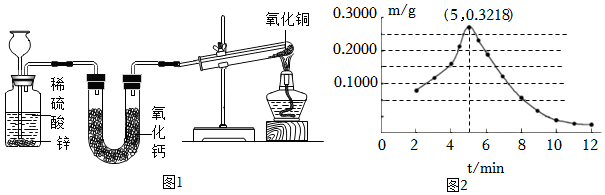
实验②:称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原,其在不同时间(t)所得固体中Cu
2O的质量(m)如图2所示。
(4)【实验结论】取实验①反应后的红色固体于烧杯中,加入氨水并搅拌,观察到
,明固体产物有Cu
2O。
(5)【实验反思】兴趣小组认为,氢气还原氧化铜的反应过程主要为“经历2CuO+H
2Cu
2O+H
2O,H
2+Cu
2O
2Cu+H
2O两个反应,且在同一条件下两个反应同时进行”。请结合实验结果和计算分析,说明“在同一条件下两个反应能同时进行”合理的依据:
。
(三)探究硫酸铜溶液与铝反应的产物
(6)【进行实验】兴趣小组同学在试管中进行如图3所示的实验,实验中发生反应的化学方程式是:
;
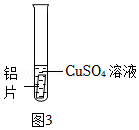
实验过程中,小组同学惊奇的发现试管中铝片表面有气泡生成,并收集了该气体。
【提出问题】生成的气体是什么呢?
【猜想与假设】猜想1:可能是SO
2;猜想2:可能是H
2;……
(7)【实验探究】甲同学用手轻轻的在盛有该气体的试管口煽动,使极少量的气体飘进鼻孔,发现该气体无气味,认为猜想1不成立,其原因是
。乙同学在甲同学实验的基础上,接着进一步实验,验证该气体为H
2。
【解释和结论】铝片表面生成的少量气泡为H
2。硫酸铜溶于水后,会发生如下变化:
①CuSO
4在水中解离出Cu
2+和SO
42﹣;②Cu
2++H
2O→Cu(OH)
2+H
+。
铝片和H
+会发生如下变化:Al+H*→Al
3++H
2↑
(8)【拓展延伸】材料1:硫酸铝溶于水也会发生类似的变化。
材料2:在一定条件下,氢氧化铝具有吸附性,可吸附水里的悬浮来质。
根据以上信息,请解释硫酸铝也可以用来净水的原因:
。



 量取9.5毫升液体
量取9.5毫升液体 过滤
过滤 氧气验满
氧气验满 倾倒液体
倾倒液体