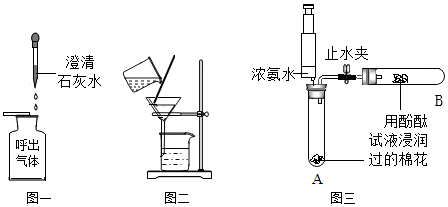
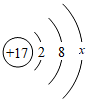24.某化学兴趣小组针对教科书中两个实验进行再探究。
【探究一】空气中氧气含量测定的再认识
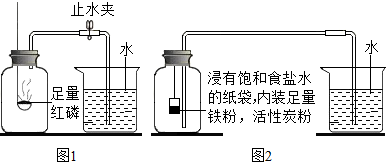
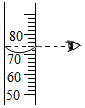
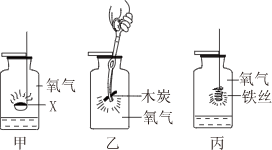
(1)测定装置如图1所示,红磷燃烧消耗氧气,使集气瓶内
减小,烧杯中的水倒吸进入集气瓶。但该实验误差较大,测得空气中氧气含量明显低于
。
【实验改进】根据铁在空气中与氧气、水蒸气等物质发生反应会生锈的原理设计实验如图2所示,装置中饱和食盐水、活性炭能加快铁生锈的速率,测得数据如下表:
| | 实验前 | 实验后 |
| 集气瓶容积/mL | 烧杯中水的体积/mL | 烧杯中剩余水的体积/mL |
| 126 | 80 | 54 |
(2)根据上表信息,空气中氧气的体积分数为
(只列式,不计算)。
(3)从实验原理角度分析,改进后的实验结果更准确的原因是
(写一点)。
【探究二】铁在氧气中燃烧后所得固体物质成分的探究
【问题1】铁燃烧时高温熔化物溅落下来的黑色物质中是否含有铁?
【资料】①铁的氧化物主要是四氧化三铁(Fe
3O
4黑色)和氧化铁(Fe
2O
3红棕色)两种;
②氧化亚铁(FeO黑色)极易被氧化为Fe
2O
3;
③铁的氧化物均能与稀盐酸反应生成铁的化合物溶液;
④铁能与稀盐酸反应生成氢气。
(4)【实验】将冷却后的黑色物质碾碎,装入试管,加入足量的稀盐酸,观察到的现象是
,说明铁燃烧时高温熔化物溅落下来的黑色物质中含有铁。
【问题2】铁燃烧的产物为什么不是Fe
2O
3?
【资料】①Fe
3O
4和Fe
2O
3的分解温度、铁的熔点见下表:
| | Fe3O4 | Fe2O3 | Fe |
| 分解温度/℃ | 1538 | 1400 | ________ |
| 熔点/℃ | ________ | ________ | 1535 |
②Fe
2O
3高温时分解成Fe
3O
4(5)【证据推理】根据实验现象及问题1的结论,结合表中的信息可知,铁在氧气里燃烧时产生的高温应在
间,此时Fe
2O
3已分解。
【拓展延伸】
(6)为了防止集气瓶炸裂,必须采取
的措施。
(7)某食品密封包装盒内放有黑色的FeO粉末,若颜色
,说明包装盒漏气。
(8)氧化铁(Fe
2O
3)高温时会分解成四氧化三铁(Fe
3O
4)和一种常见的气体,该反应的文字表达式为
。