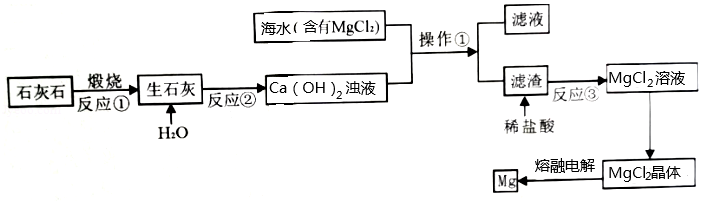
5.某学习小组将足量Zn条插入一定量的浓H
2SO
4中,发现Zn表面有大量气泡产生。(注:随着反应进行,硫酸浓度逐渐变小)
【提出问题】气体的成分是什么?
【猜想假设】
猜想一:只有SO
2; 猜想二:只有H
2; 猜想三:
【查阅资料】(Ⅰ)SO
2可以使品红溶液褪色
(Ⅱ)SO
2可以和碱性溶液反应
(Ⅲ)H
2+CuO
Cu+H
2O
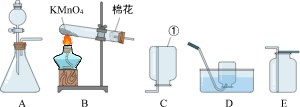
【实验探究】用如图装置验证猜想(部分夹持仪器省略)。
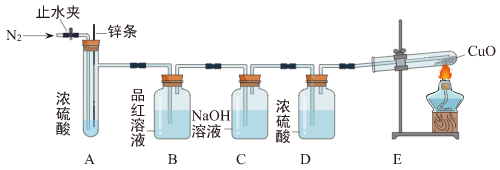
【方案设计】
| 主要实验步骤 | 主要现象 | 解释或结论 |
| ①打开止水夹,先通入一段时间N2 | / | / |
| ②关闭止水夹,将足量Zn条下放,浸入浓硫酸中,点燃E装置处酒精灯 | B装置处品红溶液褪色,E装置处
| 猜想三成立 |
| ③结束实验 | / | / |
【表达交流】
(1)在步骤①中,通入N
2的目的是:
。
(2)请你设计一个实验,用化学方法证明E装置中CuO未完全反应。
【反思拓展】
(1)请你根据上述实验探究,补充Zn与浓硫酸反应的化学方程式:
Zn+2H
2SO
4(浓)═ZnSO
4+SO
2↑+
。
(2)已知Al与H
2一样,在加热条件下能与CuO发生化学反应,请写出该反应的化学方程式
。