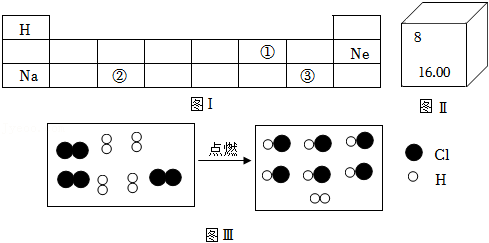
21.某化学兴趣小组将镁条用砂纸打磨后按图Ⅰ所示方案进行实验。A中缓慢产生气泡,B、C中快速产生较多气泡,且C中有白色不溶物产生。
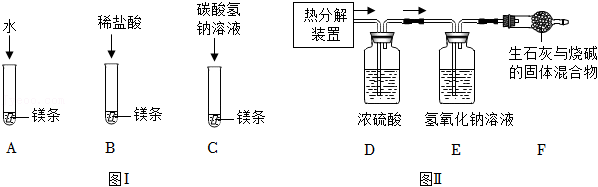
(1)图Ⅰ实验中取用镁条的仪器是
(填“药匙”或“镊子”)。
(2)同学们经过讨论获知:水能解离出少量H
+、OH
﹣,且镁与稀盐酸反应的化学方程式为:Mg+2HCl═MgCl
2+H
2↑,则A中反应的化学方程式为
。
同学们接着对C中产生的白色不溶物的成分进行了以下探究。
【提出问题】
C中产生的白色不溶物是什么呢?
【查阅资料】
①Mg(OH)
2和MgCO
3均为白色不溶物。
②Mg(OH)
2和MgCO
3均可与盐酸发生复分解反应。
③Mg(OH)
2和MgCO
3加热均易分解,分别生成两种氧化物。
④Mg(HCO
3)
2可溶于水,且不稳定,易分解为MgCO
3、H
2O、CO
2。
⑤白色的无水硫酸铜遇水会变成蓝色。
【提出猜想】
(3)猜想一:白色不溶物是纯净的Mg(OH)
2。
猜想二:白色不溶物是纯净的
。
猜想三:白色不溶物是Mg(OH)
2、MgCO
3的混合物。
【实验验证】
(4)取该白色不溶物加足量的稀盐酸,发现不溶物全部溶解,并有气体产生,则猜想
不成立。再取干燥的该白色不溶物加热分解,并将所产生的气体通过无水硫酸铜,发现无水硫酸铜变蓝,由这两个小实验得出猜想
成立。
【拓展探究】
(5)如图Ⅱ,称取干燥的该白色不溶物70.4克于热分解装置中,充分加热至不再产生气体,使分解产生的气体依次通过装置D、E,并使分解产生的气体全部被装置D、E吸收,实验后测得装置D增重3.6克,装置E增重30.8克,若该白色不溶物的组成用xMg(OH)
2•yMgCO
3表示,则x:y=
。
(6)装置F的作用是
。









 取用稀盐酸
取用稀盐酸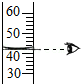 读取液体体积
读取液体体积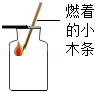 气体的验满
气体的验满 处理废弃药品
处理废弃药品
 一定量NaOH固体投入到蒸馏水中
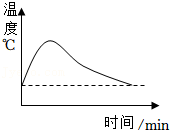
一定量NaOH固体投入到蒸馏水中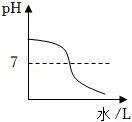 一定量NaOH溶液加水稀释
一定量NaOH溶液加水稀释 一定量NaOH溶液中滴加稀盐酸
一定量NaOH溶液中滴加稀盐酸 一定量NaOH溶液中滴加硫酸铜溶液
一定量NaOH溶液中滴加硫酸铜溶液