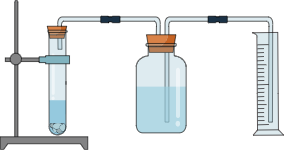
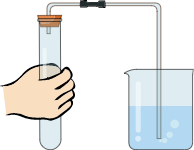
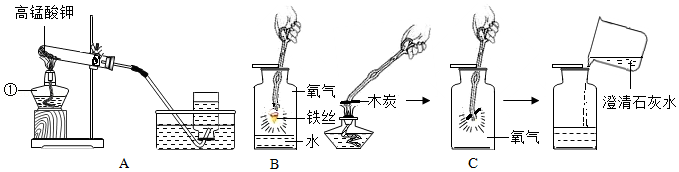
23.为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。三个小组均采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的过氧化氢溶液、二氧化锰粉末、氧化铜粉末、红砖粉末。
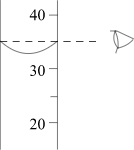
(1)【装置分析】通过测定进入量筒中水的体积,从而确定集气瓶中收集到的氧气的体积,该测定中,集气瓶内原有空气对测定结果
(填“有”或“无”)影响。
A组:探究过氧化氢溶液浓度对化学反应速率的影响
取10m L5%的过氧化氢溶液,加入0.5g二氧化锰粉末为催化剂,进行实验,记录时间t
1。
取10mL 2.5%的过氧化氢溶液,加入0.5g二氧化锰粉末为催化剂,进行实验,记录时间t
2。
(2)【实验数据】t
1 t
2。(填“>”、“=”、“<”)
【实验结论】当催化剂相同时,过氧化氢溶液浓度越大,反应速率越快。
(3)B组:探究
对化学反应速率的影响。
取10mL 5%的过氧化氢溶液和0.5g氧化铜粉末为催化剂进行实验,两次实验分别将试管置于冰水中和50℃热水中,收集10mL氧气的时间分别为t
4、t
5,且t
4>t
5。
【实验结论】当反应物浓度和催化剂相同时,温度越高,反应速率越快。
C组:探究催化剂种类对化学反应速率的影响
取三支试管,分别加入二氧化锰粉末、氧化铜粉末、红砖粉末各0.5g,再分别加入5mL 10%的过氧化氢溶液,记录收集10mL氧气的时间,数据如下:
| 固体粉末 | 二氧化锰粉末0.5g | 氧化铜粉末0.5g | 红砖粉末0.5g |
| 10%的过氧化氢溶液 | 5mL | 5mL | 5mL |
| 时间/s | 10s | 20s | 60s |
(4)【实验结论】二氧化锰粉末、氧化铜粉末、红砖粉末均可做过氧化氢溶液分解的催化剂,三者中
的催化效率最高。
(5)【实验反思】小组同学讨论后认为,由以上数据并不能得出红砖粉末有无催化作用,应该补充一个对比实验,操作为
,记录收集10mL氧气的时间。
实验结果:长时间(大于100s),收集到很少量(小于10mL)氧气。
小组验证结论:在过氧化氢分解过程中红砖粉末
(选填“有”、“无”)催化作用。
最后,老师了解到以上各组的实验设计后,建议同学们深入思考:仅探究能否改变化学反应的速率仍然不能确定其是否为催化剂,还应探究
在化学反应的前后都没有发生变化。