19.质量守恒定律的发现,对化学的发展做出重要贡献。科学家和同学们进行如下探究:
【提出问题】化学反应中,参加反应的物质质量总和与生成物的质量总和是否相等?
【进行实验】
实验一:1756年,俄国科学家罗蒙诺索夫,把锡放在密闭容器里锻烧,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。
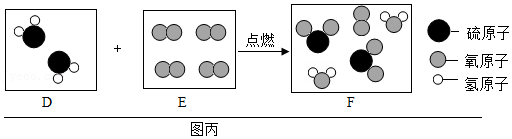
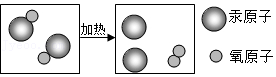
实验二:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
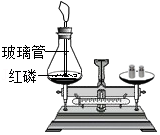
实验三:同学们利用红磷燃烧进行实验,装置如图所示,结果反应前后质量相等。
【实验分析】
(1)实验一中若放入锡的质量为m克,密闭容器内氧气的质量为n克,则生成的氧化锡的质量可能
克。
A. 等于m+n
B. 大于m+n
C. 小于m+n
(2)实验二中发生反应的微观图示如图,该反应中没有发生变化的微粒名称是
。
(3)实验三中点燃红磷后气球的变化情况为
;若锥形瓶底部不铺细沙,会导致
。
【交流讨论】
(4)下列关于上述三个实验的共同点描述中,正确的是
。
A. 三个实验中涉及的反应均属于分解反应
B. 三个实验变化前后原子的种类、数目、质量都不变
C. 三个实验中所用的药品均需稍过量,否则影响实验结果
【拓展迁移】
(5)已知氢气在氯气中燃烧,可用化学方程式表示为H
2+Cl
22X,则X的化学式为
。
(6)如图是某反应中固体物质质量变化情况,下列与之相符的化学反应是
。
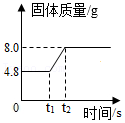
A. 2Mg+O
22MgO
B. Fe+CuSO
4═FeSO
4+Cu
C. 2Cu+O
22CuO



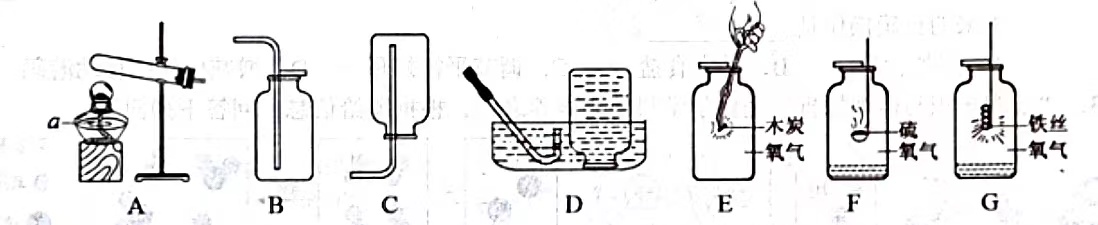
 给液体加热
给液体加热 点燃酒精灯
点燃酒精灯 点燃镁条
点燃镁条 熄灭酒精灯
熄灭酒精灯 硫在氧气中燃烧
硫在氧气中燃烧  铁丝在氧气中燃烧
铁丝在氧气中燃烧 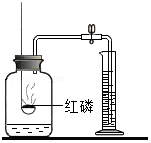 红磷测定空气中氧气含量
红磷测定空气中氧气含量  排水法收集氧气
排水法收集氧气