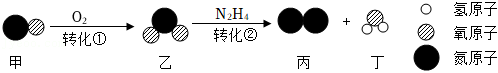
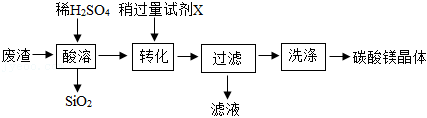
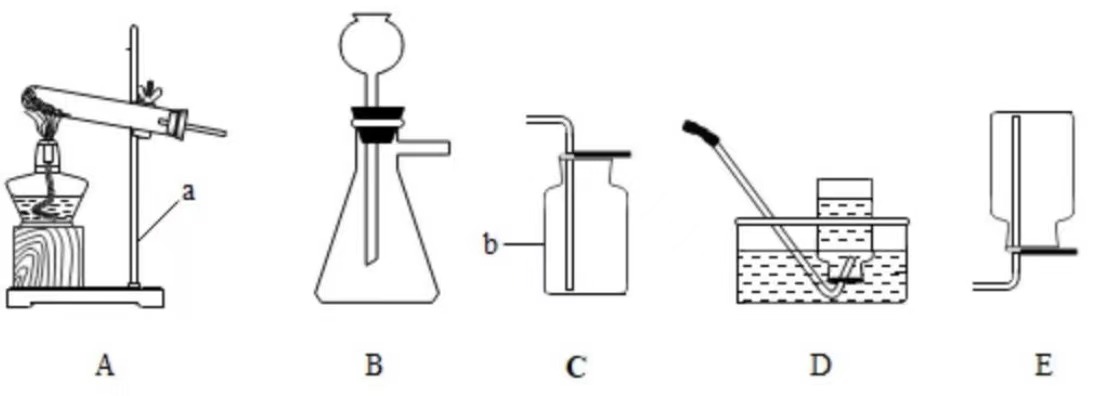
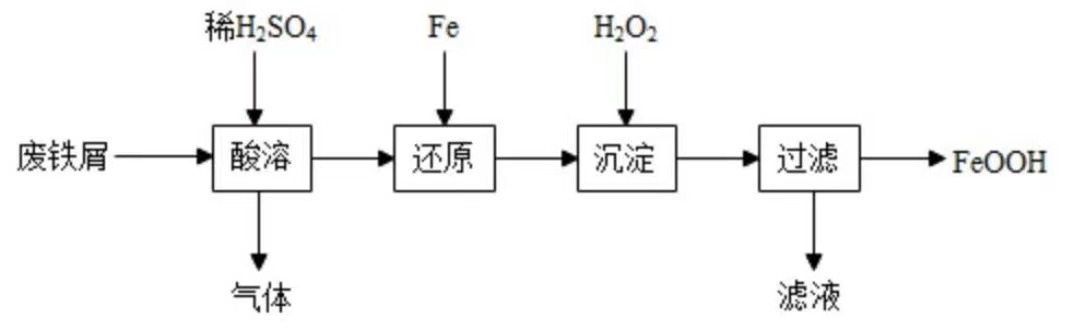
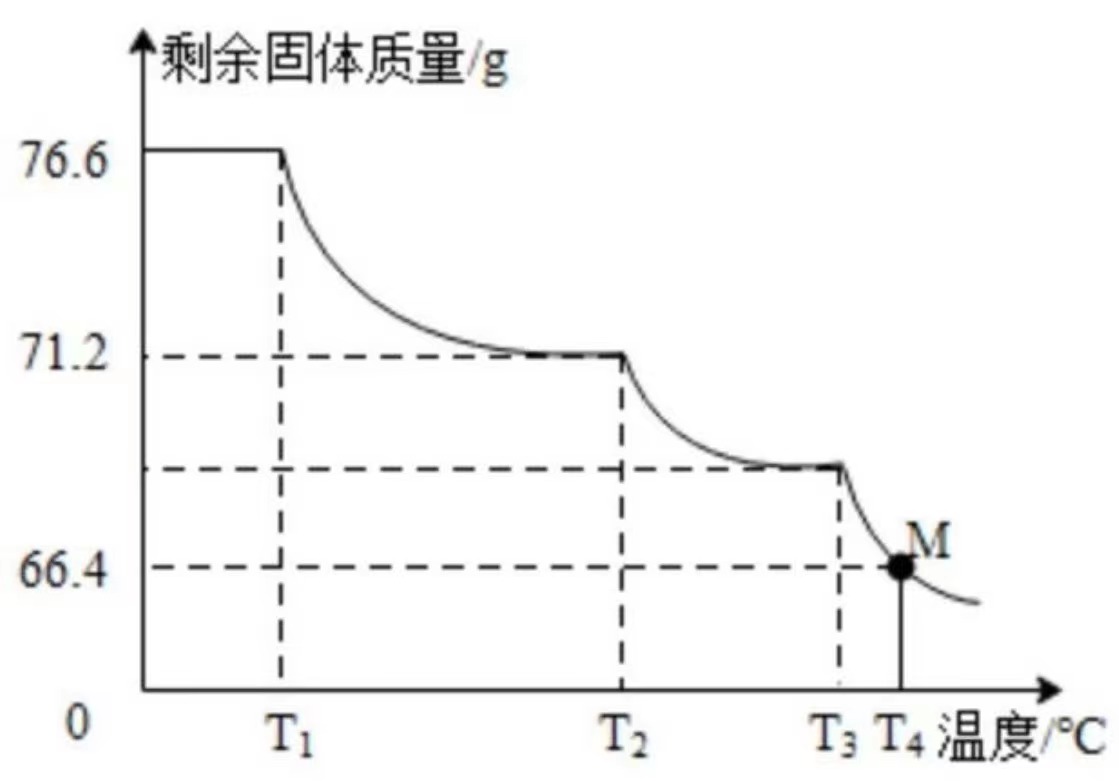
28.用下列实验探究Al与CuCl
2溶液的反应。
实验一:将打磨后的铝片插入CuCl
2溶液,铝片表面出现红色固体且产生气泡,最终溶液呈无色。
(1)生成红色固体的化学方程式为
。
(2)收集气体,
(填操作)后点燃,产生淡蓝色火焰。该气体为
。
实验二:将实验一所得无色溶液倒入水中,出现白色固体。过滤、洗涤,低温烘干。对所得白色固体作如下探究。
【资料】①AlCl
3能与H
2O作用生成Al(OH)
3。Al(OH)
3,白色固体,不溶于水,受热易分解生成Al
2O
3和H
2O。
②Al与CuCl
2溶液反应会生成CuCl。CuCl,白色固体,不溶于水,能溶于含Cl
﹣浓度较大的溶液,受热不分解。
【猜测】白色固体可能是:
a.Al(OH)
3;b.CuCl;C.Al(OH)
3和CuCl。
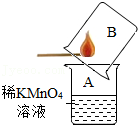
(3)【实验】取适量白色固体,利用如图装置充分加热,U型管中
,则猜测b成立。
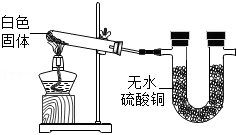
(4)【反思】无色溶液倒入水中后出现白色固体的原因是
。
实验三:CuCl在空气中被氧化成碱式氯化铜[Cu
x(OH)
yCl
z]蓝绿色固体,其受热会分解生成CuO、H
2O和HCl。取一定量蓝绿色固体,充分加热,将生成的气体依次用足量的吸水剂氯化钙和烧碱溶液充分吸收。
(5)实验测得氯化钙增重0.36g,烧碱溶液增重0.73g。则碱式氯化铜的化学式为
。



 量取
量取 稀释
稀释 产生H2
产生H2 收集H2
收集H2