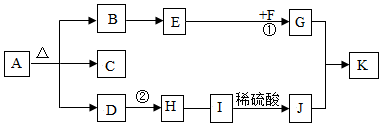
14.在七十五届联合国大会上,中国提出努力争取2060年前实现“碳中和”,实现二氧化碳的“零排放”。化学兴趣小组认为实验室可用氢氧化钠溶液吸收多余的二氧化碳,从而实现实验室二氧化碳的“零排放”。小组同学对吸收后溶液中溶质的成分产生兴趣并进行探究。
【提出问题】氢氧化钠溶液吸收二氧化碳气体后,溶液中溶质的成分是什么?
【查阅资料】
(1)CO
2与NaOH溶液反应会生成Na
2CO
3,当二氧化碳过量时,会继续反应生成NaHCO
3。
(2)NaHCO
3溶液呈弱碱性,一般不与CaCl
2溶液反应,与稀盐酸反应产生气体。
(3)CaCl
2溶液呈中性。
【作出猜想】
猜想①NaOH、Na
2CO
3猜想②Na
2CO
3猜想③Na
2CO
3、NaHCO
3猜想④NaHCO
3【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取少量待测液于试管中,加入CaCl2溶液 | 产生白色沉淀 | 猜想 不成立 |
| 步骤二:另取少量待测液于试管中,加入过量CaCl2溶液至不再产生沉淀,过滤,取少量滤液,向其中加入适量稀盐酸 | 气泡产生(填“有”或“无”) | 猜想③不成立 |
| 步骤三:另取步骤二的少量滤液,向其中滴入2~3滴无色酚酞试液 | 试液变红 | 猜想 成立 |
写出步骤一中反应的化学方程式
。
【反思与交流】
反应物的量不同,可能导致生成物的种类不同。



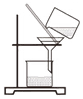 过滤浑浊河水
过滤浑浊河水 量取水的体积
量取水的体积 加热食盐水
加热食盐水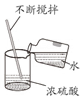 稀释浓硫酸
稀释浓硫酸