15.CuSO
4是化学实验中常见试剂。
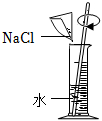
(1)验证质量守恒定律。
步骤1:在锥形瓶中加入适量的CuSO
4溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有CuSO
4溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为m
1。
步骤2:将铁钉浸入到CuSO
4溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有CuSO
4溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为m
2。
①用砂纸将铁钉打磨干净的作用是
。
②步骤2中可观察到明显的实验现象是
。该变化可说明Fe和Cu的金属活动性由强到弱的顺序是
。
③若m
1=m
2,可证明参加反应的Fe和CuSO
4的质量总和等于
。
(2)探究CuSO
4溶液对H
2O
2分解具有催化作用。
①若要证明CuSO
4溶液对H
2O
2分解具有催化作用,除需证明CuSO
4在反应前后化学性质和质量不发生改变外,还需证明的是
。
②为探究CuSO
4在反应前后质量是否发生改变,某同学设计如下实验:
向H
2O
2溶液中滴入10g a%的CuSO
4溶液,待反应完全后,向试管中加入足量的BaCl
2溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为bg。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物bg计算出溶液中CuSO
4的质量
0.1a g。(填“大于”或“小于”或“等于”)
(3)将16.0g CuSO
4置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
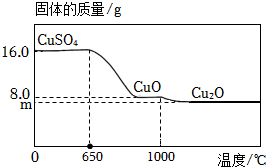
①650℃时,CuSO
4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为
。
②1000℃时,CuO开始发生分解反应,生成Cu
2O和O
2。计算图中m的值。(写出计算过程,否则不得分)