15.某同学对碳酸钠、碳酸氢钠的组成及某些性质进行探究。
【认识组成】(1)由化学式Na
2CO
3、NaHCO
3可知,两者含有的元素差别是
;从构成离子的层次看,酸根离子分别是CO
32-、HCO
3-,依据酸根离子它们都可统称为
(填“碳酸盐”或“钠盐”)。
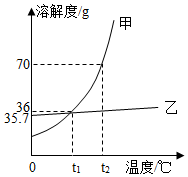
【比较性质】(2)为比较室温是20℃时Na
2CO
3、NaHCO
3与水混合的变化,按图1进行实验,先向两支试管中分别加入各约1g Na
2CO
3、NaHCO
3,再分别滴入几滴水,振荡后将温度计插入其中,发现盛有Na
2CO
3的试管中温度计的示数高于20℃,盛有NaHCO
3的试管中温度计的示数低于20℃;再向两试管中各加入约5mL水和2滴酚酞试液,振荡后液体均呈红色。则NaHCO
3与水混合时
(填“放出”或“吸收”)热量,NaHCO
3溶液显
(填“酸性”或“碱性”)。
【提出问题】(3)Na
2CO
3、NaHCO
3还有什么不同性质?
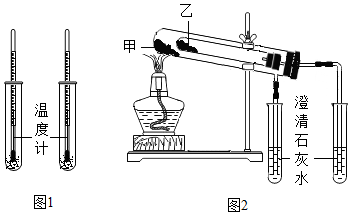
【查阅资料】NaHCO
3受热易分解生成Na
2CO
3、H
2O和CO
2.Na
2CO
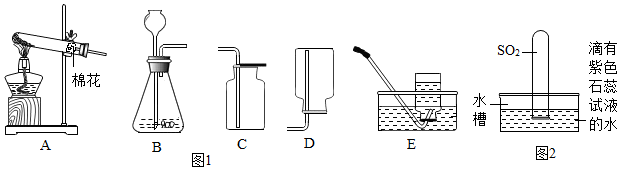
3受热不易分解。可用图2装置验证。
【进行实验】按图2连接装置,检查气密性后,分别装入相关药品(试管甲、乙中的固体质量应相等)。后续实验均按规范要求进行,完成实验。
①若要使实验效果更理想,则甲中应装入
(填“Na
2CO
3”或“NaHCO
3”)。
②完成实验后,待试管冷却至室温,若甲、乙试管里剩余固体的质量分别用m(甲)、m(乙)表示,则m(甲)
(填“>”或“=”或“<”)m(乙)。
【拓展应用】(4)若把碳酸和NaHCO
3比较,受热容易分解的是
(填“碳酸”或“NaHCO
3”)。除去Na
2CO
3粉末中混有的少量NaHCO
3的方法是
。
(5)研究表明,Na
2CO
3在水中溶解时能生成自由移动的离子,且Na
2CO
3溶液中还含有很少的HCO
3-,在Na
2CO
3溶液中存在的带负电荷的离子有HCO
3-、
、
(填离子符号)。




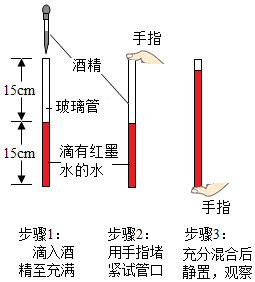 如图所示的滴有红墨水的水与酒精混合的实验,不能说明构成物质的微粒之间有空隙
如图所示的滴有红墨水的水与酒精混合的实验,不能说明构成物质的微粒之间有空隙